Sidney J Faria-e-Sousa1; Stella Barretto2
DOI: 10.17545/eoftalmo/2018.0003
RESUMO
Este artigo concentra-se na análise in vitro do endotélio das córneas doadas para transplante. Ele se refere à influência das soluções preservativas sobre o aspecto do endotélio, a lógica das análises morfológicas e morfométricas do mesmo, o padrão das perdas endoteliais agudas e seu diagnóstico diferencial, a influência da morfologia endotelial sobre regulação da hidratação da corneana e a microscopia especular.
Palavras-chave: Endotélio; Banco de Olhos; Transplante de Córnea.
ABSTRACT
This article focus on in vitro analysis of the endothelium of donated corneas for transplantation. It is about the influence of preservative solutions on the endothelium shape, the morphological and morphometric analyses of the endothelial layer, the cellular pattern of acute endothelial losses and its differential diagnosis, the role of endothelial morphology on the regulation of corneal hydration, and specular microscopy.
Keywords: Endothelium; Eye Banks; Corneal Transplantation.
RESUMEN
Este artículo presenta el análisis in vitro del endotelio de las córneas donadas para trasplante. Su contenido se refiere a la influencia de las soluciones preservativas sobre el aspecto del endotelio, la lógica de sus análisis morfológicos y morfométricos, el estándar de las pérdidas endoteliales agudas y su diagnóstico diferencial, la influencia de la morfología endotelial sobre la regulación de la hidratación de la córnea y la microscopía especular.
Palabras-clave: Endotelio; Banco de Ojos; Trasplante de Cornea.
INTRODUÇÃO
A seleção de córneas para transplantes compreende quatro estágios: inspeção ocular no cadáver, análise corneana in situ, análise corneana in vitro e microscopia especular endotelial. A inspeção implica na observação dos olhos, pálpebras e órbitas para procurar por sinais de trauma, icterícia, sangramento, secreção purulenta, tumores da conjuntiva e corpos estranhos. Ela é realizada a olho nu, com a ajuda de uma lanterna de bolso. A análise in situ é feita em lâmpada de fenda, com a córnea ainda alojada no globo ocular1. O objetivo é detectar anormalidades que possam interferir com a transparência e segurança do enxerto, mediante a avaliação do epitélio, estroma, endotélio e câmara anterior. A análise in vitro é o exame da córnea dentro do meio de conservação. A principal vantagem desse procedimento é a de permitir a observação do endotélio pelo lado interno da córnea, sem a interferência do edema estromal. Ele também é realizado em lâmpada de fenda, só que através do frasco de preservação. Os agentes de preservação mais sofisticados são comercializados em câmaras plásticas de alta transparência, especialmente projetadas esse exame. Os bancos de olhos que utilizam frascos de vidro beneficiam-se do analisador de Cowden2. Esse instrumento mantém o frasco de armazenamento na posição vertical enquanto que, auxiliado por um espelho inclinado a 45°, projeta a imagem do botão corneoescleral no plano frontal. Com ampliação de 20 a 30 vezes, é possível identificar os detalhes do mosaico endotelial (Figura 1).

Uma vez concluído que a córnea tem transparência satisfatória e não apresenta risco óbvio para o hospedeiro, o foco passa a ser o estudo da sua vitalidade, isto é, da capacidade de permanecer transparente no olho receptor. Essa característica depende da reserva funcional do endotélio que controla ativamente a hidratação do enxerto e, consequentemente, a sua transparência. Ocorre que ainda não dispomos de um método não invasivo para avaliar a função endotelial3,4. A contagem de células por unidade de área (densidade endotelial) e as análises morfológicas e morfométricas do mosaico endotelial ainda são tudo o que temos para inferirmos sobre a saúde e a função das células endoteliais. A lógica por trás desses exames é a suposição de que as alterações no número, forma e tamanho celular afetam diretamente o desempenho endotelial e vice-versa. Contudo, ainda é ignorado o quanto tal suposição é válida. Apesar dessas limitações, o objetivo da análise in vitro é o de selecionar, com base nas características do mosaico endotelial, as córneas com maior chance de sobrevivência no hospedeiro.
INFLUÊNCIA DA PRESERVAÇÃO NO FORMATO ENDOTELIAL
No período post-mortem, quando o oxigênio cai abaixo do nível crítico, a córnea passa a usar a glicólise anaeróbica, processo no qual a glicose se decompõe em lactato, fazendo com que este último se acumule no estroma na forma de um sal de sódio. Esse sal atrai fluido para o estroma, por osmose. Além disso, a depleção dos estoques de glicogênio e a diminuição da adenosina trifosfato (ATP), secundária à hipóxia prolongada, desaceleram o transporte de água do estroma para a câmara anterior. O efeito combinado desses eventos resulta em edema da córnea5. A córnea pode adquirir até o dobro da espessura padrão quando armazenada em meio líquido. O edema é um inconveniente para o cirurgião, porque córneas muito espessas dificultam a colocação das suturas no enxerto. Para minimizar o edema, agentes hiperosmóticos, como dextrano e sulfato de condroitina, foram adicionados aos meios líquidos. No entanto, logo se reconheceu que tais agentes causavam intoxicação celular quando ingeridos pelas células endoteliais6-9. Isso levou à retirada dos mesmos dos meios de cultura de órgãos, já que temperaturas acima de 30ºC aumentam a fagocitose celular. Entretanto, eles foram mantidos nos meios de preservação a frio, pois a hipotermia, própria das preservações a 4ºC, reduz a penetração intracelular10.
No meio de preservação a frio, o mosaico endotelial é exposto a duas tendências antagônicas: ao edema, devido à inibição hipotérmica da bomba endotelial, e à desidratação, promovida pelos agentes hiperosmóticos. No edema, as células endoteliais tornam-se anormalmente abauladas; na desidratação, anormalmente emaciadas, com núcleo saliente. Em ambos os casos, os limites celulares tornam-se mal definidos, dificultando a análise e a contagem endotelial. Experimentos mostram que, com a elevação da temperatura do tecido, as células endoteliaisrecuperam a hidratação regular e os limites celulares. É aconselhável, portanto, manter os frascos de armazenamento à temperatura ambiente (23°C), por pelo menos 40 minutos antes das análises teciduais. Na verdade, um estudo controlado indicou que o tempo ideal para a visibilidade do mosaico endotelial é de, no mínimo, 2 horas11. A boa visibilidade do mosaico melhora a chance da feitura da estimativa correta da densidade endotelial (células/ mm2).
A LÓGICA DAS ANÁLISES MORFOLÓGICAS DO ENDOTÉLIO
A lógica das análises morfológicas do endotélio baseia-se nas seguintes observações: a partir dos 5 anos de idade até a morte, ocorre perda anual de aproximadamente 0,6% das células endoteliais12. O declínio celular se acelera com cirurgias intra-oculares, inflamação da câmara anterior, anóxia corneana, glaucoma e córnea guttata13-17. Devido à incapacidade de reprodução do endotélio, as células mortas deixam espaços vazios, para serem preenchidos pelas células adjacentes, que se estendem ou deslizam na direção da lesão. Em virtude disso, a camada endotelial adquire aspecto heterogêneo, com grande variedade de formatos e tamanhos celulares18,19,20.
No curto prazo, a perda endotelial gera variabilidade celular21,22. No longo, o padrão hexagonal tende a se recuperar20,fazendo com que a superfície interna da córnea se torne revestida de células endoteliais aumentadas e de formato uniforme (Figura 2). O examinador experiente é capaz de estimar a densidade celular com base apenas no tamanho das células - tamanho grande equivale a número pequeno de células.
PERDAS ENDOTELIAIS AGUDAS
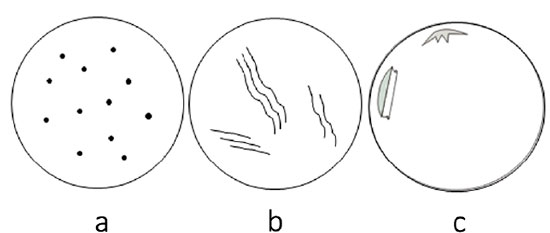
As perdas endoteliais agudas, por lesões mecânicas da córnea, nas vizinhanças da morte, deixam espaços vazios no mosaico endotelial, justificados pela ausência de tempo para uma resposta compensatória. Esses vazios aparecem como pontos escuros ou acinzentados, com distribuição focal ou linear (Figura 3)23, espalhados aleatoriamente ao longo do mosaico endotelial. As perdas celulares de formato linear sinuoso são chamadas de “rastro de lesma”(snail tracks)24.
O padrão da perda celular sugere a natureza do trauma. Por exemplo, as perdas focais, espalhadas por todo o mosaico endotelial como “tiro de chumbinho” (birdshot), indicam trauma corneano frontal compressivo (Figura 4a). As do tipo “rastro de lesma” (Figura 4b) indicam lesão por tração excessiva da córnea durante a remoção do botão corneano ou à compressão das células nos recessos das dobras de Descemet. Descolamentos da membrana de Descemet sugerem lesão endotelial involuntária, causada pelos instrumentos cirúrgicos por ocasião da retirada da córnea (Figura 4c).
CÓRNEA GUTTATA
As células endoteliais secretam o colágeno que forma a membrana de Descemet. Durante a vida intra-uterina, essa estrutura apresenta configuração em faixas e, no nascimento, espessura de aproximadamente 3 μm. Ao longo da vida, ela continua engrossando, mas à custa de um colágeno homogêneo e sem faixas. Aos 70 anos, sua espessura atinge cerca de 13 μm25. Quando uma inflamação, trauma ou distúrbio genético irritam as células endoteliais, elas tendem a responder com a produção de colágeno fetal, em taxa acelerada26,27, gerando espessamento reativo, focal ou difuso, da membrana de Descemet. As lesões focais projetam-se na câmara anterior como verrugas. A córnea normal apresenta pequeno número dessas verrugas no endotélio periférico, sob o nome de corpúsculos de Hassall-Henle. Essas lesões não têm importância clínica. Entretanto, quando surgem na córnea central, com aumento progressivo e espalhamento gradual para a periferia, deve-se considerar a possibilidade de uma enfermidade endotelial evolutiva denominada córnea guttata ou distrofia guttata. A lesão típica é a “gutta” que, em Português, significa “gota”. Guttata descreve o aspecto orvalhado do endotélio afetado. Apesar de ter perfil abaulado, as guttas geram a ilusão de buracos negros à reflexão especular (Figura 5c). No começo, as guttas são menores que a célula. Com o progresso da enfermidade, elas adquirem o tamanho de várias áreas celulares. As células endoteliais que cobrem as lesões tornam-se paulatinamente maiores e mais finas.
A córnea guttata é uma doença intrínseca da célula endotelial28 que afeta os dois olhos assimetricamente. Geralmente se manifesta após os 50 anos e é mais prevalente em mulheres29. Essa distrofia faz com que as células voltem a produzir membrana basal fetal em ritmo acelerado e, nesse processo, reduz drasticamente tempo de vida das mesmas. Quando o número de células se torna insuficiente para manter o equilíbrio fluídico da córnea, o estroma corneano incha. A córnea guttata acompanhada de edema estromal configura a condição chamada de distrofia de Fuchs. A visão diminui com o aumento do inchaço e, acima de um determinado nível de edema, o epitélio também é envolvido, tornando-se colonizado por microbolhas de água. Ao se romperem, essas bolhas causam dor intermitente e a sensação de corpo estranho. O espessamento focal ou difuso da membrana de Descemet, decorrente de inflamações ou traumas, configura a guttata secundária. Nessa variedade, as lesões limitam-se à área do endotélio primariamente afetado, detalhe que ajuda no diagnóstico diferencial com guttata genuína.
Alguns bancos de olhos distribuem córneas com uma quantificação ordinal da guttata. Com isso, compartilham com os cirurgiões a responsabilidade de seus achados. Julgamos essa prática inadequada. Geralmente, os cirurgiões não têm experiência suficiente para decidir sobre as sutilezas do exame in vitro. Não havendo dúvida sobre a irrelevância das lesões encontradas no exame endotelial, o banco de olhos deve distribuir o tecido. Caso contrário, a córnea deverá ser destinada apenas aos transplantes que não exijam a troca do endotélio.
DIAGNÓSTICO DIFERENCIAL DAS LESÕES ENDOTELIAIS
Na análise in vitro as perdas endoteliais (Figura 5a) e as guttas (Figura 5c) manifestam-se como pontos escuros no mosaico endotelial. O diagnóstico diferencial entre essas duas entidades é relevante. No primeiro caso, a córnea pode ser usada, desde que a densidade e a morfologia endotelial estejam dentro de limites aceitáveis. No segundo, a córnea pode ter uma doença que a desqualifica para transplantes convencionais, independentemente da contagem endotelial. Complicando esse cenário, ainda existe uma terceira possibilidade: a vesícula endotelial ou pseudoguttata. Elas também se manifestam como pontos escuros. (Figura 5b). São aglomerados lineares de células endoteliais edemaciadas, semelhantes às observadas nos usuários de lentes de contato com baixa permeabilidade ao oxigênio21. Aparentemente, essas lesões resultam do efeito combinado do aumento da permeabilidade da membrana da célula endotelial, secundária à hipóxia post-mortem30, com a hipotermia tecidual decorrente da preservação a 4ºC. Elas desaparecem com a elevação da temperatura do meio de armazenamento. Esse achado é outro motivo para que os frascos de armazenamento sejam mantidos em temperatura ambiente (23 °C) por pelo menos 40 minutos antes dos tecidos serem analisados.
Às vezes, o diagnóstico diferencial entre a guttata e a perda celular se torna desafiador. Nesse caso, é importante ter-se em mente que a primeira afeta ambos os olhos, que as lesões são sempre mais numerosas no centro da córnea e que a enfermidade é mais prevalente nas mulheres com mais de 50 anos. As perdas endoteliais têm distribuição aleatória e não se associam com o sexo ou a idade. Em muitos casos, a microscopia especular elucida essas dúvidas, em virtude da maior ampliação das imagens.
MORFOLOGIA ENDOTELIAL E REGULAÇÃO DA HIDRATAÇÃO CORNEANA
O endotélio controla a hidratação da córnea, mantendo-a desinchada e transparente. A hipótese dominante é que exista para essa tarefa uma troca de fluidos entre a córnea e a câmara anterior do tipo “vazamento-bombeamento”. Nessa troca, proteínas especializadas da membrana da célula endotelial bombeiam de volta para a câmara anterior o fluido absorvido pelo estoma. Mesmo que os detalhes operacionais desse sistema não estejam totalmente esclarecidos, o processo parece necessitar de Na +, K +, HCO3-, Cl-, ATPase e anidrase carbônica. Aparentemente, ele se utiliza do sistema de transporte de ânions da parede basolateral (voltada para o estroma) e dos canais de transporte de água e íons da parede apical (voltada para o humor aquoso) das células endoteliais31.
A força com a qual a córnea absorve a água é conhecida como pressão de embebição. Essa força decorre das propriedades higroscópicas dos glicosaminoglicanos espalhados entre as lamelas estromais32. O fluxo passivo de fluido, da câmara anterior para o estroma corneano, usa a via paracelular (intervalo entre as células) da camada endotelial, que é regulada pelas junções ocludentes da membrana apical das células33. O estroma incha quando o bombeamento não consegue compensar o vazamento; nessa situação, a pressão de embebição diminui, na medida em que o edema progride. Esse ciclo só é interrompido com o reequilíbrio entre a pressão de embebição e o bombeamento celular, num novo patamar de espessura córnea.
O vazamento endotelial paracelular despertou interesse no estudo da influência do espaço intercelular na regulação da hidratação corneana. A camada endotelial é formada por células hexagonais regulares. Dentre os três padrões regulares de tesselação - triângulo, quadrado e hexágono - o último é o que exibe o menor perímetro por unidade de área. Consequentemente, a extensão do espaço intercelular do mosaico endotelial é o menor possível. Esse detalhe anatômico poupa o trabalho da bomba, deixando um sítio mínimo para o vazamento de fluido. Ao longo da vida, a perda natural das células endoteliais gera mosaicos com células progressivamente maiores. Desde que se preserve a configuração celular uniforme, células grandes oferecem menor espaço intercelular à câmara anterior. Um aumento de x vezes na área celular gera um aumento de √x vezes no perímetro do espaço intercelular. Em termos relativos, essa condição corresponde a uma diminuição desse espaço. Essa propriedade é vantajosa para a córnea porque diminui a demanda de bombeamento à medida que a densidade celular diminui. Estudos em humanos e em animais confirmaram a associação de células grandes com a baixa permeabilidade do mosaico endotelial34-36. Por outro lado, se variabilidade do tamanho celular aumenta, a extensão do espaço intercelular aumenta, gerando mais vazamento pela via paracelular. Estas observações apoiam a suposição de que mosaicos endoteliais com células de tamanho e forma uniformes são os que melhor mantêm a função de barreira37.
Bourne et al. formularam a teoria de que a diminuição da reserva funcional do endotélio poderia ser explicada exclusivamente pela redução da extensão do espaço intercelular34,36,38. Uma das premissas dessa hipótese é que as enzimas responsáveis pela função de bomba concentram-se exclusivamente nas paredes laterais das células endoteliais e, com a diminuição do perímetro intercelular, essas enzimas se tornariam mais escassas39,40. Estudos posteriores, entretanto, mostraram que as enzimas com função de bomba permeiam toda a membrana celular31. Além disso, O’Neal e Polse encontraram uma diminuição significativa da função da bomba endotelial nos mosaicos irregulares41 que, por razão puramente geométrica, têm extensão intercelular aumentada. Polse et al.42 propuseram que a idade, por si só, poderia explicar a diminuição do controle da hidratação corneana. Essa proposta foi fundamental para alertar que outros fatores, além da geometria celular, poderiam influenciar na regulação da hidratação da córnea. Atualmente, os estudos pertinentes a esse assunto têm se concentrado na fisiologia da própria bomba e nos mecanismos de controle do fluxo paracelular31,33.
Independentemente das controvérsias sobre o controle da hidratação da córnea, uma informação importante emerge dessa questão. Com o envelhecimento, o endotélio perde células, gerando tanto mosaicos homogêneos de células grandes quanto mosaicos irregulares com ampla variabilidade de tamanhos e formas celulares. Embora no primeiro caso haja menos vazamento, ambos apresentam diminuição no controle da hidratação da córnea por razões ainda não esclarecidas36,41. Essa observação sustenta a opinião, derivada do senso comum, de que córneas idosas saudáveis não devam ter o mesmo desempenho que o das córneas jovens saudáveis.
POLIMEGETISMO E PLEOMORFISMO
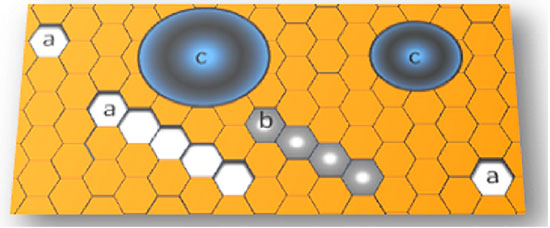
O polimegetismo é a variabilidade excessiva da área celular, manifesta por um mosaico endotelial composto por células de tamanhos variados43. O fenômeno é quantificado pelo coeficiente de variação da área das células endoteliais (VC), representado pela razão entre o desvio padrão e a área celular média de um campo específico de observação. No endotélio adulto saudável, esse coeficiente não ultrapassa 30%5,22. Outra forma de quantificar o polimegetismo é pela razão entre a área celular máxima e mínima de um campo de observação. O normal é que ele não ultrapasse o valor 522 O pleomorfismo é a variabilidade excessiva da forma celular. Ele é estimado indiretamente pela porcentagem de células de seis lados. A medida que ele aumenta, a porcentagem de células hexagonais cai. O endotélio saudável apresenta no mínimo 60% das suas células com formato hexagonal44. O polimegetismo e o pleomorfismo estão interligados pela lei de Mullins-von Neumann45, que especifica que partículas com áreas com mais de seis lados se expandem, enquanto que as com menos lados se encolhem, o equilíbrio sendo representado pela configuração hexagonal (Figura 6).
Apesar da tendência de associarmos o polimegetismo ao processo de reparação do mosaico endotelial, ele também pode surgir da hipóxia tecidual, desvinculada das perdas celulares22,46, como o observado em usuários de lentes de contato de baixa permeabilidade ao oxigênio47-49. A variabilidade da área celular, sem a correspondente alteração da densidade endotelial (células/mm2), é justificada pelo aumento do tamanho de algumas células em detrimento da redução de outras50. Outra possibilidade é que o tamanho das células não mude; que o fenômeno se deva a uma reorientação espacial da massa celular, de modo que as células com grandes superfícies apicais tenham pequenas áreas basais e vice-versa51.
Um evento intrigante é a concomitância do polimegetismo com uma densidade endotelial normal em não usuários de lentes de contato37,52. Esse achado sugere a existência de uma terceira fonte de polimegetismo, desvinculada tanto da perda celular quanto da hipóxia. Tendo em vista que a variabilidade do tamanho das células aumenta com a idade, essa terceira fonte poderia ser uma combinação de fatores, na qual o envelhecimento celular tenha alguma participação53.
Córneas com a mesma densidade endotelial podem apresentar níveis distintos de recuperação do edema secundário à hipóxia e ao trauma37,52,54,55,56. Elas têm, portanto, distintas reservas funcionais. Reserva funcional é a capacidade da camada endotelial de reverter o edema corneano52. Esse achado gerou a suspeita de que a estimativa da densidade celular seja importante, porém não suficiente para prever a qualidade da reserva funcional do endotélio. Na busca de outros parâmetros que contornassem essa deficiência, o interesse voltou-se para as variações morfológicas do mosaico endotelial e, mais especificamente, para o polimegetismo e o pleomorfismo52. Vários estudos mostraram a correlação entre o polimegetismo e a menor capacidade de reversão do edema da córnea secundário às cirurgias intraoculares e ao uso de lentes de contato37,43,54,55,56. Como consequência, o polimegetismo passou a ser interpretado como uma manifestação do estresse endotelial que precede ou49 sucede a perda celular. Nesse entendimento, as córneas com VC anormal teriam menores chances de sobrevivência após o transplante de córnea. Na verdade, essa hipótese seria muito atrativa, caso o polimegetismo derivasse exclusivamente da perda celular. Como isso não ocorre, há quem não acredite nela, alegando que a função e o fenótipo endotelial possam se recuperar no interior do meio de preservação ou do próprio olho hospedeiro57,58. A dúvida sobre a importância das alterações morfológicas da camada endotelial é uma das razões pelas quais a densidade endotelial continua sendo o critério mais objetivo para seleção de tecidos.
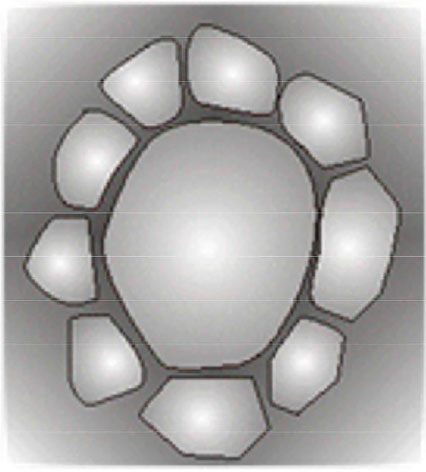
Os microscópios especulares modernos empregam programas computacionais para quantificar o polimegetismo e o pleomorfismo. Embora os limites numéricos de normalidade para esses fenômenos já tenham sido estabelecidos, até o momento não dispomos de nenhum protocolo consensual para a seleção das córneas com base nessas informações. Essa é outra razão pela qual a densidade celular continua sendo o principal parâmetro de seleção do endotélio de córneas doadas. Na ausência da contagem celular automática, podemos nos valer da estimativa da freqüência das rosetas - formações celulares em que várias células pequenas circundam uma maior -tendo-se em vista que o número delas aumenta com a exacerbação do polimegetismo (Figura 7)37,46. Entretanto, esse procedimento tem a mesma limitação da análise computacional, ou seja, a falta de definição do número de rosetas, por campo de estudo, necessários para que se qualifique a córnea como imprópria para transplantes.
MICROSCOPIA ESPECULAR
A microscopia especular é o próximo exame após a análise in situ do endotélio corneano, fazendo parte da análise in situ sensu lato. O instrumento projeta um feixe de luz na córnea e captura a imagem refletida da interface entre o endotélio e o humor aquoso. As vantagens de o microscópio especular sobre a lâmpada de fenda incluem, imagens maiores e contagem celular automatizada. Embora a densidade celular não seja o único parâmetro na avaliação da qualidade do endotélio, ela ainda é a informação mais concreta disponível para os profissionais de bancos de olhos. Quando se utiliza a densidade endotelial como critério de seleção, presume-se que a contagem celular elevada aumente a probabilidade de sobrevida do enxerto. De fato, inúmeras publicações reforçam essa interpretação ao indicarem a densidade endotelial inicial como o principal fator de influência na sobrevivência do enxerto59-61.
Como tanto o tempo de armazenamento a frio62-64 como a própria cirurgia de transplantes tendem a diminuir a densidade endotelial do enxerto, os bancos de olhos levam em consideração esses fatos para definir a densidade celular mínima da córnea para enxerto. Em uma amostra de 72 enxertos transparentes, com 10 anos de evolução, Ing et al.65 observaram que a densidade endotelial era o equivalente a um terço da inicial, com área celular média de 958 ± 471 mm2. Muitos bancos de olhos, incluindo o nosso, estabelecem arbitrariamente a densidade endotelial mínima de 2.000 células/mm2 para qualificar a córnea como apropriada para transplantes penetrantes66. Com a adoção desse critério e baseado nos achados de Ing et al., a expectativa da densidade endotelial ao final de 10 anos é de 660 células/mm2. Esse número é compatível com a transparência dos enxertos67.
REFERÊNCIAS
1. Transplantation of the cornea. Arch Ophthamol.1935;13(3):321-347. https://doi.org/10.1001/archopht.1935.00840030011001
2. Cowden JW. Slit-lamp attachment for examination of donor corneas in MacCarey-Kaufman medium. Arch Ophthalmol.1979;97(5):953. https://doi.org/10.1001/archopht.1979.01020010511029
3. Horn DLV, Schultz RO. Corneal preservation: Recent advances. SurvOphthalmol 1977;12(4);301-312. https://doi.org/10.1016/0039-6257(77)90112-6
4. Wilson SE, Bourne WM. Corneal preservation. SurvOphthalmol 1989;33(4):237-259. https://doi.org/10.1016/0039-6257(82)90150-3
5. Liesegang TJ. Physiologic changes of the cornea with contact lens wear.The CLAO Journal 2000;28(1):12–27.
6. Lindstrom RL, Doughman DJ, Skelnik DL, Mindrup EA. Corneal preservation at 4C with chondroitin sulfate containing medium. Trans Am OphthalmolSoc 1987;85,1987.
7. McCarey BE, Kaufman HE. Improved corneal storage. Invest Ophthalmol Vis Sci1974;13:165-173.
8. Lindstrom RL, Kaufman HE, Skelnik BS, et al. Optisol corneal storage medium. Am J Ophthalmol 1992;114(3):345-356. https://doi.org/10.1016/S0002-9394(14)71803-3
9. Pels E, Beele H, Claerhout I. Eye bank issues: II. Preservation techniques: warm versus cold storage. IntOphthalmol. 2008 Jun; 28(3): 155–163. doi: 10.1007/ s1079200790861
10. Faria-e-Sousa SJ, Barretto S. Preservação de córneas: uma breve história. Corneal preservation: A brief history. E-Oftalmo.CBO. Submitted to publication.
11. Pham C, Hellier E, Vo M, Szczotka-Flynn L, Benetz BA, Jonathan H. Lass J H. Donor Endothelial Specular Image Quality in Optisol GS and Life4ºC International Journal of Eye Banking 2013;1(2):1-8.
12. Bourne WM, Nelson LR, Hodge DO. Central corneal endothelial changes over a ten-year period. Invest Ophthalmol Vis Sci 1997;38(3):779-782.
13. Bourne WM, Kaufman HE. Endothelial damage associated with intraocular lenses. Am J Ophthalmol 1976;81(4);482-486. https://doi.org/10.1016/0002-9394(76)90305-6
14. AlfawazAM, Holland GM, Yu F et al. Corneal endothelium in patients with anterior uveitis. Ophthalmology 2016; 123(8):1637-1645 https://doi.org/10.1016/j.ophtha.2016.04.036.
15. McMahon TT, Polse KA, McNamara N, et al. Recovery from induced corneal edema and endothelial morphology after long-term PMMA contact lens wear. Optom Vis Sci 1996;73:184–188. https://doi.org/10.1097/00006324-199603000-00010
16. Spencer WH, Ferguson WJ Jr, Shaffer RN, Fine M. Late degenerative changes in the cornea following breaks in the Descemet's membrane. Tran Am AcadOphthalmolOtolaryngol 1966;70(6):973-983.
17. Elhalis H, Azizi B, Jurkunas UV. Fuchs Endothelial Corneal Dystrophy. Ocul Surf. 2010;8(4):173–184. https://doi.org/10.1016/S1542-0124(12)70232-X
18. DoughmanDJ, Van Horn D, Rodman WP, Byrnes P, Lindstrom RL. Human corneal endothelial layer repair during organ culture. Arch Ophthalmol. 1976; 94(10):1791-1796. https://doi.org/10.1001/archopht.1976.03910040565016
19. Matsuda M, Sawa M, Edelhauser HF, Barrels SP, Neufeld AH, Kenyon KR. Cellular migration and morphology in corneal endothelial wound repair. Invest Ophthalmol Vis Sci. 1985; 26 (4):443-449.
20. Yee RW, Geroski DH, Matsuda M, Champeau EJ, Meyer LA, Edelhauser HF. Correlation of corneal endothelial pump site density, barrier function, and morphology in wound repair. Invest Ophthalmol Vis Sci. 1985; 26 (9):1191-1201.
21. ZantosSG and Holden BA: Transient endothelial cell changes soon after wearing soft contact lenses. Am J OptomPhysiolOpt 1977;54(12):856-858. https://doi.org/10.1097/00006324-197712000-00010
22. Stocker EG, Schoessler JP. Corneal endothelium polimegatism induced by PMMA contact lens wear. Invest Ophthalmol Vis Sci 1985;26(6):857-863.
23. Marcomini LAC, Sobral RMCR, Seixas GO, Faria e Sousa SJ. Seleção de córneas para transplantes. Rev. Bras. Oftalmol 2011;70(6):430-436. https://doi.org/10.1590/S0034-72802011000600020
24. Alfonso E, Tucker GS, Battle JF, Mandelbaum S, Gelender H, Forster RK. Snailtracks of the corneal endothelium. Ophthalmology 1986;83(3):344-349 https://doi.org/10.1016/S0161-6420(86)33736-9
25. Johnson DH, Bourne WM, Campbell RJ. The ultrastructure of Descemet's membrane. I. Changes with age in normal corneas. Arch Ophthalmol. 1982;(12)100:1942- 1947. https://doi.org/10.1001/archopht.1982.01030040922011
26. Johnson DH, Bourne WM, Campbell RJ. The ultrastructure of Descemet's membrane. II. Aphakic bullous keratopathy. Arch Ophthalmol 1982;100(12):1948- 1951. https://doi.org/10.1001/archopht.1982.01030040928012
27. Warin III GO. Posterior collagenous layer of the cornea. Ultrastructural classification of abnormal collagenous tissue posterior to Descemet's membrane in 30 cases. Arch Ophthalmol. 1982;100(1):122-134. https://doi.org/10.1001/archopht.1982.01030030124015
28. Biswas S, Munier FL, Yardley J, et al. Missense mutations in COL8A2, the gene encoding alpha2 chain of type VIII collagen, cause two forms of corneal endothelial dystrophy. Hum Mol Gent. 2001;10(21):2415-2423. https://doi.org/10.1093/hmg/10.21.2415
29. KrachmerJH, Purcell JJ Jr.,Young CW, Bucher KD. Corneal endothelial dystrophy. A study of 64 families. Arch Ophthalmol. 1978;96(11):2036-2039. https://doi.org/10.1001/archopht.1978.03910060424004
30. Holden BA, Williams L, Zantos SG. The etiology of transient endothelial changes in the human cornea. Invest Ophthalmol Vis Sci 1985;26:1354–1359.
31. Bonanno JA. Molecular mechanism underlying the corneal endothelial pump. Exp Eye Res. 2012;95(1):2-7. https://doi.org/10.1016/j.exer.2011.06.004
32. Lindstrom RL. Advances in corneal preservation. Trans Am. OphthalmolSoc1990;88:555-648.
33. Srinivas SP. Dynamic regulation of barrier integrity of the corneal endothelium. Optom Vis Sci. 2010;87(4): E239-E254. https://doi.org/10.1097/ OPX.0b013e3181d39464.
34. Bourne WM, Brubaker RF. Decreased endothelial permeability in transplanted corneas. Am J Ophthalmol. 1983; 96(3):362-367. https://doi.org/10.1016/S0002-9394(14)77828-6
35. Bourne WM, Nelson L R, Buller CR, Huang PT, Geroski DH, Edelhauser HF. Long-term observation of morphologic and functional features of cat corneal endothelium after wounding. Invest Ophthalmol Vis Sci. 1994; 35(3):891-899.
36. Bourne WM. Functional measurements on the enlarged endothelial cells of corneal transplants. Trans Am Ophthalmol Soc. 1995;93:65-79.
37. Rao GN, Aquavella JV, Goldberg SH et al. Pseudophakic bullous keratopathy: Relationship to preoperative corneal endothelial status. Ophthalmology 1984;91(10):1135–1140. https://doi.org/10.1016/S0161-6420(84)34168-9
38. Bourne WM. Clinical estimation of corneal endothelial pump function. Trans Am Ophthalmol Soc. 1998; 96: 229–242.
39. Kaye GI, Tice LW: Studies on the cornea. V. Electron microscopic localization of adenosine triphosphatase activity in the rabbit cornea in relation to transport. Invest Ophthalmol Vis Sci 1966;5(1): 22-32.
40. Geroski DH, Edelhauser HF. Quantitation of Na/k ATPase pump sites in the rabbit corneal endothelium. Invest Ophthalmol Vis Sci 1985; 25(9):1056-1060, 1984
41. O'Neal MR, Polse KA. Decreased endothelial pump function with aging. Invest Ophthalmol Vis Sci 1986;27(4): 457-463.
42. Polse KA, Brand R, Mandell R, et al: Age differences in corneal hydration control. Invest Ophthalmol Vis Sci 1989; 30 (3):392-399.
43. Rao GN, Shaw EL, Arthur EJ, and Aquavella JV: Endothelial cell morphology and corneal deturgescence. Ann Ophthalmol 11:885, 1979.
44. McCarey BE, Edelhauser HF, Lynn MJ. Review of corneal endothelial specular microscopy for FDA clinical trials of refractive procedures, surgical devices and new intraocular drugs and solutions. Cornea 2008;27(1):1-16. https://doi.org/10.1097/ICO.0b013e31815892da
45. Wörner CH, Olguín A, Ruíz-García JL, Garzón-Jiménez N. Cell Pattern in Adult Human Corneal Endothelium CH.PLoS One, 2011: 6 (5):1-5( e19483).
46. Holden BA, Sweeney DF, Vannas A, Nilsson KT, Efron N.Effects of long-term extended contact lens wear on the human cornea. Invest. Ophthalmol. Vis Sci.1985; 26(11):1489-1501.
47. Carlson KH, Bourne WM, Brubaker RF. Effect of long-term contactlens wear on corneal endothelial cell morphology and function. InvestOphthalmol Vis Sci 1988;29 (2):185–193.
48. MacRaeSM, Matsuda M, Shellans S. Corneal endothelial changesassociated with contact lens wear. CLAO J 1989;15:82–87.
49. MacRae SM, Matsuda M, Phillips DS. The long-term effects of polymethylmethacrylate contact lens wear on the corneal endothelium. Ophthalmology 1994;101(2):365–370. https://doi.org/10.1016/S0161-6420(94)31327-3
50. Schoessler JP, Orsborn GN. A theory of corneal endothelial polymegethism and aging. Cur Eye Res.1987; 6 (2):301-306. http://dx.doi.org/10.3109/02713688709025182
51. Bergmanson JP. Histopathological analysis of corneal endothelial polymegethism. Cornea. 1992;11(2):133-142. https://doi.org/10.1097/00003226-199203000-00007
52. Shaw EL, Rao GN, Arthur EJ, Aquavella JV. The functional reserve of corneal endothelium. Ophthalmology. 1978;85(6):640-649. https://doi.org/10.1016/S0161-6420(78)35634-7
53. Laing RA, Sanstrom MM, Berropsi AR, Leibowitz HM. Changes in the corneal endothelium as a function of age. Exp Eye Res 1976;22(6):587-594. https://doi.org/10.1016/0014-4835(76)90003-8
54. Bourne WM, Richard F, Brubaker RF, O'Fallon M. Use of air to decrease endothelial cell loss during intraocular lens implantation. Arch Ophthalmol. 1979; 97(8):1473-1475.https://doi.org/10.1001/archopht.1979.01020020135009
55. PoIse KA, Brand RJ, Cohen SR, Guillon M. Hypoxic effects on corneal morphology and function. Invest Ophthalmol Vis Sci. 1990;31(8): 1542-1554.
56. Nieuwendaal CP, Odenthal MT, Kok JH, Venema HW, Oosting J, Riemslag FC, Kijlstra A. Morphology and function of the corneal endothelium after long-term contact lens wear. Invest Ophthalmol Vis Sci. 1994;35 (7):3071–3077.
57. Bruinsma M, Lie JT, Groeneveld-van Beek EA, Liarakos VS, van der Wees J, Melles GR. Are polymegethism, pleomorphism, and "poor swelling" valid discard parameters in immediate postmortem evaluation of human donor corneal endothelium? Cornea. 2013;32(3):285-9. https://doi.org/10.1097/ICO.0b013e318253b1a6.
58. Doughty MJ. The ambiguous coefficient of variation: Polymegethism of the corneal endothelium and central corneal thickness. International Contact Lens Clinic. 1990:17(9)240-248. https://doi.org/10.1016/0892-8967(90)90064-M
59. Bourne WM. Cellular changes in transplanted human corneas. Cornea 2001;20(6):560-569. https://doi.org/10.1097/00003226-200108000-00002
60. Armitage WJ, Dick AD, Bourne WM. Predicting endothelial cell loss and long-term corneal graft survival. Invest Ophthalmol Vis Sci 2003;44:3326–3331.
61. Nishimura JK, Hodge DO, Bourne WM. Initial endothelial cell density and chronic endothelial loss rate in corneal transplants with late endothelial failure. Ophthalmology1999;106(10):1962-1965. https://doi.org/10.1016/S0161-6420(99)90409-8
62. Bourne WM, Nelson LR, Maguire LJ et al. Comparison of Chen medium and Optisol-GS for human corneal preservation at 4ºC. Results of transplantation. Cornea 2001;20(7):683-686. https://doi.org/10.1097/00003226-200110000-00003
63. Pels E, Schuchard Y. Organ-culture preservation of human corneas. Doc Ophthalmol. 1983;56(1-2):147–153. https://doi.org/10.1007/BF00154722
64. Bourne WM. Endothelial cell survival on transplanted human corneas preserved at 4 C in 2.5% Chondroitin Sulfate for one to 13 Days. Am J Ophthalmol. 1983;103(3):382-386
65. Ing JJ, Ing HH, Nelson LR, Hodge DO, Bourne WM. Ten-year postoperative results of penetrating keratoplasty. Ophthalmology 1998;105(10):1855-1865. https://doi.org/10.1016/S0161-6420(98)91030-2
66. Borderie VM, Scheer S, Touzeau O et al. Donor organ cultured corneal tissue selection before penetrating keratoplasty Br J Ophthalmol. 1998;82(2):382-388. https://doi.org/10.1136/bjo.82.4.382
67. Lass JH, Sugar A, Bentez BA, et al.; Cornea Donor Study Investigator Group. Edothelial cell density to predict endothelial graft failure after penetrating keratoplasty. Arch Ophthalmol. 2010;128(1):63-69. https://doi.org/10.1001/archophthalmol.2010.128.63

Financiamento: Nada a declarar.
Parecer CEP: não aplicável.
Conflito de interesses: Declaram não haver.
Recebido em:
8 de Janeiro de 2018.
Aceito em:
15 de Março de 2018.