André Correa de Oliveira Romano
DOI: 10.17545/e-oftalmo.cbo/2015.11
RESUMO
O rápido desenvolvimento da tomografia de coerência óptica (OCT) resultou no surgimento de novos sistemas que variam em desempenho e funcionalidade e recriam imagens volumétricas in vivo do segmento anterior e posterior com uma velocidade excepcional. O escaneamento do tecido, à níveis histológicos, em milhões de scans/s através de novos Swept source OCTs, coloca esta tecnologia em patamares inimagináveis. No futuro próximo, a combinação do OCT com óptica adaptiva (AO) permitirá a correção de aberrações estáticas e dinâmicas do olho, possibilitando análise celular retiniana. O objetivo deste artigo é introduzir os vários aspectos do desenvolvimento desta tecnologia dentro do contexto de suas aplicações oftalmológicas, bem como, o impacto de novos OCTs de analise funcional.
Palavras-chave: Tomografia de Coerência Óptica. OCT. Angiografia OCT. Traduzir Optical Coherence. Tomography Angiography. OCTA. En face OCT. Diagnostic Imaging. Imaging of Retina, cornea, glaucoma.
ABSTRACT
The rapid development of optical coherence tomography (OCT) and its ophthalmic applications has resulted in new systems that vary in performance and functionality providing in vivo three-dimensional volumetric reconstructions of both anterior and posterior segments of the human eye within unimaginable speed. Newer swept source OCT systems have made it possible to achieve OCT acquisition speeds of several million A-scans/s. Another direction of OCT development includes the introduction of adaptive optics to imaging of the posterior segment of the eye that allows correction of the eye’s static and dynamic aberrations, resulting in the achievement of volumetric cellular resolution retinal imaging. The purpose of this article is to present the various aspects of the development of OCT technology within the context of its ophthalmic applications, as well as, the impact of functional OCT.
Keywords: Tomography, Optical Coherence; OCT, OCT angiography, Optical Coherence Tomography, Angiography, OCTA, En face OCT, Diagnostic Imaging, Imaging of Retina, cornea, glaucoma
INTRODUÇÃO
Com base no enorme progresso nos últimos anos, o diagnóstico por imagem em oftalmología atingiu altos níveis de sofisticação. O grande número de equipamentos mostra claramente que há uma necessidade em desenvolver um diagnóstico rápido e preciso. Isto conduziu à exploração de combinações de técnicas de imagiologia e da contribuição de grupos no mundo todo que tentam resolver estas deficiências.
A tomografia de coerência óptica (OCT), uma técnica não invasiva de imagem de alta resolução que fornece imagens transversais da retina, córnea e nervo óptico, tem contribuído de forma extraordinária neste sentido.1 Sua evolução ao longo da última década como um dos exames complementares mais importantes na prática oftalmológica é incontestável.
Com a resolução axial de 5 a 7 micra fornece detalhes in-vivo da estrutura e camadas das retinas e outros tecidos oculares, funcionando como uma espécie de "biópsia óptica.” Por este motivo, além da oftalmología, tem sido usada nos diversos campos da medicina: dermatologia, cardiología, oncología, ginecologia, odontologia, entre outras. Fora do âmbito médico, ela tem sido usada em arte para analisar as diferentes camadas de uma pintura, inclusive na detecção de fraudes.
O objetivo deste estudo é apresentar o impacto da tomografia de coerência óptica na oftalmología, bem como os recentes avanços e as futuras perspectivas que desta tecnologia nos próximos anos.
MÉTODOS
HISTÓRIA DO OCT
A tomografia de coerência óptica foi desenvolvida a partir dátese de doutorado do estudante, David Huang, do programa combinado da Faculdade de Medicina da Universidade de Harvard e do Instituto de Tecnologia de Massachusetts (MIT). Desenvolvida no laboratório de engenharia elétrica capitaneado pelo orientador Dr. James Fujimoto, a tese tinha como objetivo inicial a medida do comprimento axial e da espessura corneana. No entanto, descobriu-se um potencial sem precedentes para análise não invasiva, com altíssima resolução da retina e outros tecidos oculares.1
O experimento conduzido com ajuda do Dr. Joel Schuman, oftalmologista, em Harvard, levou várias horas para adquirir uma única imagem. Para melhorar a velocidade de imagem, Fujimoto recrutou Eric Swanson, que então trabalhava em comunicações ópticas no MIT Lincoln Laboratory. Os primeiros testes clínicos de escaneamento de retina foram conduzidos pelo grupo do Dr. Carmen Puliafito que estava então no Massachusetts Eye and Ear Infirmary, Harvard Medical School. (Figura 01)

PRINCÍPIOS BÁSICOS
A OCT proporciona alta resolução porque baseia-se na luz, ao invés de som ou rádio frequência. Um feixe óptico é dirigido ao tecido, e uma pequena porção desta luz refletida abaixo da superfície do tecido é coletada.
É importante salientar que grande parte da luz não é refletida, mas, sim, dispersada por todos os lados. No entanto, em OCT, a coerência óptica é utilizada para gravar o comprimento do percurso óptico de fótons recebidos, permitindo rejeição da maioria deles que se dispersaram antes da detecção. Desta forma a OCT é capaz de coletar imagens tridimensionais de tecidos espessos, rejeitando o sinal de fundo durante a coleta de luz diretamente refletida das superfícies de interesse.
A técnica é baseada na análise e detecção do sinal de interferência produzido entre uma reflexão de referência e o sinal refletido. O princípio consiste em um interferômetro (conhecido com interferômetro de Michelson) com uma fonte de luz de baixa coerência e grande largura espectral. A luz é dividida nas portas de referência e amostra e depois recombinada no detector.
A luz em um sistema de OCT é dividido em dois braços: o braço da amostra (que contém área de interesse) e um braço de referência (geralmente um espelho).
A combinação de luz refletida a partir do braço de amostra e de luz de referência a partir do braço de referência dá origem a um padrão de interferência, mas somente se a luz a partir de ambos os braços ter percorrido a mesma distância óptica.
FORMAÇÃO (GERAÇÃO) DA IMAGEM
O princípio da OCT é semelhante ao do ultra-som de modo B e do radar, em que o tempo de atraso da onda refletida é usado para medir a profundidade da estrutura-alvo. Ao contrário do ultra-som, a OCT pode adquirir imagens sem que seja necessário o contato com o tecido. (Figura 02)
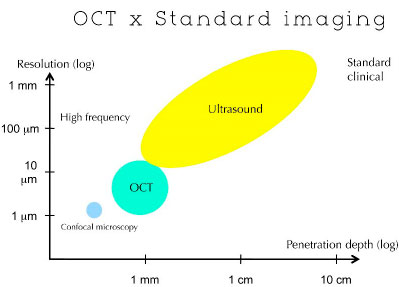
As áreas da amostra mais refletoras criarão uma interferência mais intensa. Qualquer luz que tenha atraso maior que o comprimento de coerência não interferirá. Este perfil de refletividade é chamado A-scan, e contém informação sobre a dimensão e posição axial das estruturas dentro da amostra. Uma imagem tomográfica de seção transversal (B-scan) pode ser obtida combinando-se uma série de varreduras axiais (A-scan).2
A geração de imagem En Face (C-scan) em uma profundidade específica é possível variando a posição da amostra com relação ao feixe de prova.
Nesse caso a luz refletida é medida em uma profundidade determinada, o espelho de referência fica fixo e a posição de feixe é varrida na amostra, sucessivas varreduras, em x e em y. Esse modo de varredura é similar ao que é usado na microscopía confocal.
PRINCÍPIOS BÁSICOS
TIPOS DE OCT
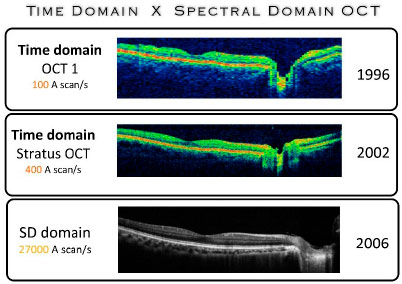
OCT de Domínio de tempo (TD-OCT)
O primeiro OCT utilizou o sistema de domínio de tempo (TD-OCT) para obter cortes transversais da retina e da córnea. Este método foi apresentado em três gerações de OCT de retina (OCT1, OCT2 e Stratus OCT) e no OCT Visante (Carl Zeiss Méditée, Dublin, CA, EUA), para a avaliação do segmento anterior ocular.
Neste tipo de sistema a luz de baixa coerência é produzida por uma fonte de diodo superluminescente, que é acoplada ao interferômetro. O interferômetro apresenta um divisor de feixes que divide o feixe de luz em um feixe de referência e outro feixe de varredura. O primeiro é direcionado a um espelho de referência móvel, ao passo que o último é direcionado ao olho. Ambos os feixes são refletidos de volta para um detector do sinal. O padrão de interferência gerado pelos dois feixes refletidos fornece informações sobre a distância e a espessura das estruturas alvo (córnea, retina, etc).
Taxas de escaneamento no OCT de domínio do tempo (TD-OCT) chegam de 400 A-scans por segundo com uma resolução axial de 8-10 micra no tecido. Com esta velocidade, as imagens tridimensionais in vivo das estruturas oculares eram raras devido às limitações físicas e técnicas do método.
OCT NO DOMÍNIO DE FOURIER
Há duas maneiras de detectar e analisar o sinal óptico em tomografia por coerência óptica no dominio de Fourier: OCT espectral (Spectral optical coherence tomography OCT) ou OCT com a fonte com comprimento de onda variável (Swept Source OCT). Na primeira, utiliza-se um espectrómetro e um analisador multicanais (CCD [Charged Coupled Device] linear -) e na segunda, uma fonte laser cuja frequência óptica é variada muito rapidamente. (Figura 03)
OCT DE DOMÍNIO ESPECTRAL (SD-OCT)
A OCT de Domínio Espectral (SD-OCT) tem um espelho de referência fixo, sem limitações mecânicas. A interferência obtida com o espelho também é fixa. O sistema utiliza o braço detector do interferômetro como espectrómetro. A análise Fourier do interferograma espectral produz o escaneamento axial (Scan-A). Outra característica deste sistema é o escaneamento do espectro da fonte de luz (OCT de varredura da fonte). As informações de um escaneamento são simultaneamente adquiridas por uma câmera. Devido á rápida taxa de transferência de quadros da câmera e ao algoritmo de análise Fourier, a tecnologia FD aumentou em até 100 vezes a coleta de dados sem reduzir a sensibilidade. Outra vantagem foi manter a sensibilidade do sistema independente da resolução axial. Esses recursos permitiram a aquisição e a reconstrução de imagens tridimensionais oculares in vivo com alta resolução axial em curto espaço de tempo (segundos ou frações de segundos). (Figura 03)

Em 2006, o primeiro SD-OCT foi introduzido no mercado, seguido por várias outras companhias e com uma resolução axial de 5 a 7 micra. Um dos grandes diferenciais desta tecnologia foi o aumento de até 100 vezes na velocidade de varredura do tecido, variando de 20.000 a 52.000 A-scans por segundo e proporcionando substancialmente a diminuição de artefatos de imagem, um dos maiores problemas encontrados na geração anterior, principalmente no que tange confiabilidade e reprodutibilidade da imagens, especialmente em pacientes com dificuldade de fixação.
Consequentemente, estes equipamentos apresentam uma habilidade de digitalizar uma grande área da retina, com reconstrução volumétrica, que pode ser visto em três dimensões com a ajuda de software. Isso mudou a capacidade de análise da área avaliada, transcendeu-a para regiões fora da fóvea com habilidade para medida da área e volume.
Com incorporação de outras tecnologias como retinografia colorida e fluoresceínica, indocianina verde, microperimetria, autofluorescência, entre outras, estes instrumentos ficaram conhecidos como multimodais. (Figura 04)

SWEPT SOURCE OCT (SS-OCT)
Estão entre as vantagens do Swept-source OCT sobre o OCT espectral: a velocidade (200.000 a 400.000 Hz comparados com 25.000 a 70.000 KHz) e a capacidade criar imagens com comprimento de onda de 1050 nm, melhorando, desta forma, sua qualidade através de meios menos transparentes. Como conseqüência, nota-se uma melhor visualização de estruturas como coróide e nervo óptico.3
O impacto destas novas tecnologias será certamente enorme, reduzindo extremamente a necessidade de exames invasivos, levando à reformulação de conceitos clínicos e protocolos terapêuticos e promovendo uma prática médica mais personalizada.
Os primeiros OCTs já estão no mercado, DRI OCT-1 (Atlantis; Topcon) para segmento posterior e OCT SS-1000 (Tomey GmbH, Erlangen, Germany) para segmento anterior. O primeiro possui velocidade de aquisição de 100.000 A-scans por segundo que facilitaria a exploração de áreas maiores (12x8 mm) e a reconstrução tridimensional de todo polo posterior.
Estes sistemas podem atingir velocidades de até de 6.700.000 A-scans por segundo em protótipos de pesquisa (Fourier-domain mode-locked laser) recentemente reportado.4,5
Velocidades desta magnitude pode permitir que, pela primeira vez, a taxa de vídeo em tempo real tridimensional para aplicações tais como orientação intra-operatória.
INOVAÇÕES ATUAIS
TRACKING E MOTION CORRECTION TECHNOLOGY
Uma variedade de fatores, tais como movimentos involuntários dos olhos ou micro-saccades (especialmente em pacientes com problemas fixação) podem degradar significativamente a qualidade da imagem através da introdução de artefatos de movimento. O efeito dessas mudanças dependem principalmente do plano de imagem que está sendo examinado.
Uma das soluções incorporadas na atual geração de OCT foi a introdução do eye-tracking, seja através de hardware como encontrado no sistema Spectralis (Heidelberg) ou por software utilizados nos equipamentos da Optovue (Fremont, Ca) ou Carl Zeiss (Dublin, Ca).
No entanto, embora a direção da varredura principal apresente poucos artefatos de movimento, a direção secundária ou lenta (perpendicular à direção de principal) mostra distorções frequentemente e bastante significativas e isto impede análise confiável de dados tridimensionais (3D-OCT).
Entre as abordagens para suplantar este problema estariam o aumento da velocidade de aquisição da imagemõ e processamento posterior da mesma.6
Um alternativa brilhante que não dependeria da utilização de OCTs de altíssima velocidade tão pouco processamento posterior, é utilização de um novo algoritmo conhecido como MCT (Motion Correction Technology).7
Ele baseia-se em identificar artefatos em um volume tridimensional nos eixos vertical e horizontal, em seguida, entrelaçando os dois conjuntos de dados em um único algoritmo. (Figura 05)
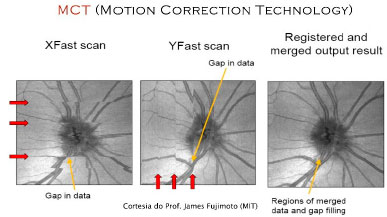
Esta tecnologia passa ter um efeito imediato na avaliação de imagens em En Face e na confiabilidade das medidas de fluxo sanguíneo através de OCT angiography.
EDI e FULL DEPTH IMAGING
Um dos métodos de avaliação mais utilizados na atualidade é o EDI (enhanced depth imaging) ou DCI (deep choroidal imaging).-Através desta técnica é possível melhorar a avaliação das camadas mais profundas da retina, coróide e interface escleral. Nos SD-OCT, que utilizamos atualmente, há basicamente duas formas de chegar a este resultado.
A primeira é através da diminuição do ruído da imagem (speckle noise) e que pode ser realizada de diversas maneiras. A mais tradicionalmente usada é o image averaging, que consiste em calcular a mediana de múltiplas imagens de uma mesma região reduzindo a quantidade de ruídos, por conseguinte, melhoraríamos substancialmente a qualidade a imagem.9
Outra forma baseia-se em modificar a linha “zero-delay”. Esta linha é ponto de referência que o software utiliza para captura da imagem e é padronizada na junção vítreo-retiniana, proporcionando excelente resolução dos detalhes da retina. No entanto, recentemente, foram adicionados aos softwares protocolos em que linha “zero-delay” é modificada em direção as camadas mais profundas da retina, desta forma podemos apreciar os detalhes da coriocapilar, camadas de Sattler, Haller e interface coroido-escleral.8
Contudo, com a modificação desta técnica somada à outros parâmetros, podemos ter visualização do vítreo até esclera em uma única imagem sem que precisemos lançar mão de um sistema SS-OCT.
A fusão dos parâmetros supracitados à ampliação da área de penetração axial de 2,3 mm para 3 mm e o aumento da sensibilidade do sinal, permitiria um acréscimo entre 500 a 800 micra dependendo da quantidade de pigmentação e outros fatores como comprimento axial (míopes). (Figura 06)

A combinação destas técnicas resultam em uma única imagem com detalhes do vítreo até coróide conhecida como Full Depth Imaging (FDI). (no prelo, Romano et al)
EN FACE OCT
Diferentes protocolos de varredura podem ser realizados para gerar imagens de tomografia de coerência óptica. Secções transversais podem ser adquiridas com prioridades tanto para a direção axial (profundidade) como para a direção transversal.
Fazendo a varredura nas duas direções transversais é possível adquirir imagens en-face de uma profundidade específica. A varredura en-face é relativamente nova do ponto de vista clínico. Porém, sua capacidade excede os métodos tradicionais com os quais estamos acostumados a observar com o OCT.10
Imagem en Face tem a grande vantagem de que oftalmologistas estão mais familiarizados com a interpretação de imagens transversais, uma vez que são de orientação semelhante, aos encontrados no exame de retinografia.
Com essa técnica é possível selecionar imagens tridimensionais em diferentes planos e determinar a localização exata de uma patologia, oferecendo uma melhor observação da área de interesse, permitindo identificação e alterações microestruturais, assim como de uma área mais extensa do tecido a ser avaliado, impossível com os módulos tradicionais de escaneamento.
Ela permite, dessa forma, a identificação de alterações subclínicas, que podem vir a ser marcadores precoces de progressão da doença.10,11
OCT ANGIOGRAPHY E DOPPLER OCT
A angiografia por tomografia de coerência óptica (OCTA) é uma nova técnica não-invasiva de alta resolução de imagens angiográficas do fluxo sanguíneo geradas em questão de segundos.
Para reconstrução do mapa de fluxo sanguíneo, o OCTA compara as diferenças entre intensidade ou amplitude de sinal entre diferentes B-Scans em um dado tempo.
Esta tecnologia requer velocidades de varredura elevadas, maior que as encontradas na maioria dos sistemas disponíveis atualmente. Cada conjunto de varredura tridimensional leva aproximadamente seis segundos para aquisição.
As imagens en-face do angiograma pode ser manuseadas a partir da membrana limitante interna (ILM) até a coróide, visualizando os plexos vasculares individualmente, segmentando a retina interna, externa, coriocapilar, ou qualquer outra área de interesse.
As áreas de aquisição do angiograma variam de 2 x 2 mm a 12 x 12 mm, com a qualidade de digitalização sendo reduzida conforme aumenta-se o campo de visão.
O campo de 3 x 3 mm parece ser o de melhor resolução que os usados atualmente em exames de fluoresceínografia e ICG. Matsunaga et al sugere que estes mostrariam uma qualidade significativa de detalhes.12
OCTA expõe o fluxo sanguíneo em um ponto fixo no tempo. (Figura 07) Embora vazamentos não sejam apreciáveis, pode-se medir a área e o volume, úteis em casos tais como membrana neovascular subretiniana (MNVSR). (Figura 08)
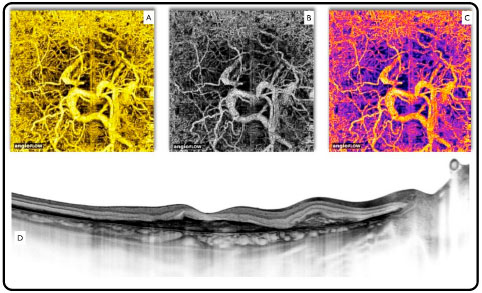
É especialmente útil na identificação de MNVSR tipo 1 devido a localização de difícil acesso e imprecisa com fluoresceína e ICG.
Por outro lado, a análise do fluxo sanguíneo pode ser impedida ou obstruída em casos de hemorragias densas onde o acesso as camadas retinianas tornam-se difíceis.
A grande vantagem do OCTA reside no fato de realizar simultaneamente análise morfológica e funcional (fluxo sanguíneo). Isto pode colocar esta tecnologia em outro patamar na avaliação de doenças da retina e nervo óptico, visto que as maiores causas de cegueiras irreversíveis estão associadas à circulação anormal do nervo óptico e macula (glaucoma, retinopatia diabética e degeneração macular). Nestes casos é possível, além de observar o notável detalhamento dos capilares retiniananos, avaliar a densidade vascular nas patologias supracitadas. (Figura 09)
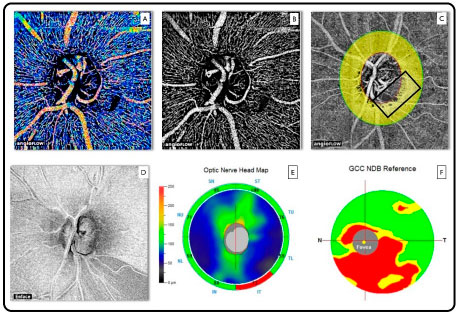
O único sistema de OCTA comercialmente disponível até a presente data é AngioVue software que utiliza um algoritmo específico conhecido como SSADA (split-spectrum amplitude decorrelation angiography) no sistema Avanti (Optovue, Inc, Fremont, CA). O equipamento realiza varreduras volumétricas de 304 x 304 A-scans em uma velocidade de 70,000 A-scans por segundo em cerca de 3 segundos.
O software produz angiogramas em diversas configurações 2x2 mm, 3x3 mm, 6x6 mm, and 8x8 mm e segmentação automática dos plexos vasculares retinianos superficiais e profundos, além da coriocapilar.
O único sistema de OCTA comercialmente disponível até a presente data é AngioVue software que utiliza um algoritmo específico conhecido como SSADA (split-spectrum amplitude decorrelation angiography) no sistema Avanti (Optovue, Inc, Fremont, CA). O equipamento realiza varreduras volumétricas de 304 x 304 A-scans em uma velocidade de 70,000 A-scans por segundo em cerca de 3 segundos.
O software produz angiogramas em diversas configurações 2x2 mm, 3x3 mm, 6x6 mm, and 8x8 mm e segmentação automática dos plexos vasculares retinianos superficiais e profundos, além da coriocapilar.
FUTURAS PERSPECTIVAS
ADAPTIVE OPTICS OPTICAL COHERENCE TOMOGRAPHY (AO-OCT)
Tomografia de coerência óptica fornece imagens com resolução axial sem precedentes, mas sua resolução transversal é ruim, por conta disso, a visualização de células da retina ainda não é possível.
A resolução axial do OCT depende das propriedades de coerência da fonte de luz, onde atualmente é de aproximadamente em 5 micra, o suficiente para atingir as dimensões axiais da maioria das células retinianas.
No entanto, a resolução transversal é limitada em cerca de 15 a 20 mieras nos sistemas comerciais.
A óptica adaptiva (AO) foi desenvolvida para corrigir estas aberrações ópticas e melhorar a resolução transversal. Sistemas de óptica adaptativa medem as aberrações monocromáticas que ocorrem no olho e corrige-os usando um sensor de frente de onda e espelhos deformáveis.
A resolução fornecida pelo sistema de óptica adaptativa permite a aquisição de imagens de altíssima qualidade, permitindo a visualização de detalhes finos de fotorreceptores, microcirculação retiniana, lamina cribiforme e microestruturas dentro da camada de fibras nervosas e camada de células ganglionares. (Figura 10).
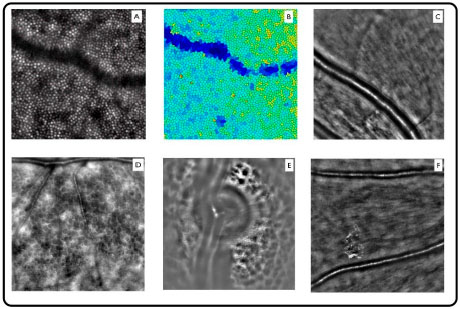
As primeiras aplicações de AO associadas ao OCT foram registrados apenas alguns anos atrás13, com as primeiras imagens de cones humanos sendo demonstrada em 2.005.14
Uma visão geral do AO-OCT pode ser encontrado em uma recente revisão.15
A óptica adaptativa combinada ao OCT pode mudar complemente a forma como interpretamos doenças oculares, porém, a sua utilização na prática clínica rotineira ainda é limitada por um pequeno campo de visão.
BIOMEDICAL IMAGING, NANOMEDICINA E OCT
O uso de contraste em oftalmologia foi descrito no anos 60 com um método para visualização de vasos de retina e coróide.16
A fluoresceína tornou-se rapidamente um dos exames mais importantes na identificação e classificação em uma variedade de doenças vasculares.
Embora as técnicas de imagem da retina continuam a evoluir a um ritmo acelerado, as deficiências consideráveis ainda existem. Contudo, a combinação de tecnologias como OCT com biomarcadores moleculares apresentam-se como uma nova modalidade no horizonte.
Nesta abordagem, contrastes exógenos com receptores específicos podem ser utilizados para melhorar a capacidade do OCT, desta forma permitindo visualização de tipos de células ou processos bioquímicos.17
Nos últimos anos, o uso de nanopartículas tem sido cada vez explorada.18
Nanopartículas de ouro são usadas na tomografia computadorizada (TC) para a identificação de tumores.19
Em oftalmología, as nanopartículas podem atuar em conjunto com a tomografia de coerência óptica monitorando a sobrevivência das células ganglionares em pacientes com glaucoma, bem como avaliação da fisiología e alterações do epitélio pigmentário da retina (EPR) em distintas doenças retinianas.20
BIOMICROSCOPIA PELO OCT
Com advento dos SD-OCTs criou-se urna nova perspectiva ao combinar OCTs de segmento anterior e posterior em um único instrumento, desta forma analisando-se, ainda que separadamente, retina, coróide, ñervo óptico, córnea ou ângulo da câmara anterior.
Um nova modalidade de OCTs conhecida como vertical cavity surface emitting lasers oferece a oportunidade de ampliar ainda mais esta capacidade, captando imagem de todo olho de uma única vez.21
Este equipamento é capaz de capturar imagens com uma amplitude de 50 mm, desta forma, recriando todo globo ocular tridimensionalmente em uma única imagem.
Isto talvez, possa representar a reinvenção da avaliação ocular com a introdução da biomicroscopia pelo OCT, porém com um nível de detalhamento nunca antes visto. A documentação de características patológicas da córnea, íris, cristalino (análise de progressão da catarata e espessura do cristalino), processo inflamatorio da câmara anterior e vítreo, bem como afecções que acometem retina (macular e retina periférica), coróide, nervo óptico e esclera.
Além disso, abre-se uma gama de novos horizontes com a analise funcional de todas estas estruturas supracitadas.
CONCLUSÃO
Apesar de muitos avanços na tecnologia do oct, a imagiologia funcional promete levar oct para um outro patamar.
É provável que, assim como para a radiologia, na virada do século 20, diagnóstico por imagem em oftalmología irá desenvolver em seu próprio campo especializado, onde os oftalmologistas tornar-se-ão especialistas em imagem.
Técnicas com medida do fluxo sanguíneo por doppler oct, óptica adaptiva combinada ao oct entre outras, mudarão a nossa compreensão do mecanismos das doenças e por fim, o campo emergente da imagiologia molecular irá proporcionar uma nova visão dos processos patológicos dinâmicos da retina, como a inflamação, isquemia e apoptose, e fornecerá informações sobre a susceptibilidade à doença e progressão da mesma.
Em um cenário sem precedentes, estas informações proporcionarão à introdução de novas opções terapêuticas na prática oftalmológica diária à partir da sala de consultas com biomicrocopia ocular pelo oct.
REFERÊNCIAS
1 Huang D, Swanson EA, Lin CP, Schuman JS, Stinson WG, Chang W, Hee MR, Flotte T, Gregory K, Puliafito CA, et al. Optical coherence tomography. Science. 1991 Nov 22;254(5035):1178-81.
2 Podoleanu AG, Rosen RB. Combinations of techniques in imaging the retina with high resolution. Prog Retin Eye Res. 2008 Jul;27(4):464-99.
3 Lim H, Mujat M, Kerbage C, Lee EC, Chen Y, Chen TC, de Boer JF. High-speed imaging of human retina in vivo with swept-source optical coherence tomography. Opt Express. 2006 Dec 25;14(26): 12902-8.
4 Klein T, Wieser W, Reznicek L, et al. Multi-MHz retinal OCT. Biomed Opt Express 2013;4:1890-908.
5 T. Klein, W. Wieser, R. Andre, T. Pfeiffer, C. M. Eigenwillig, and R. Huber, “Multi-MHz FDML OCT: snapshot retinal imaging at 6.7 million axial-scans per second,” Optical Coherence Tomography and Coherence Domain Optical Methods in Biomedicine Xvi 8213(2012).
6 S. Ricco, M. Chen, H. Ishikawa, G. Wollstein, and J. Schuman, “Correcting motion artifacts in retinal spectral domain optical coherence tomography via image registration,” Medical Image Computing and Computer- Assisted Intervention - Miccai 2009, Pt I, Proceedings 5761, 100-107 (2009).
7 Kraus MF, Liu JJ, Schottenhamml J, Chen CL, Budai A, Branchini L, Ko T, Ishikawa H, Wollstein G, Schuman J, Duker JS, Fujimoto JG, Hornegger J. Quantitative SD-OCT motion correction with tilt and illumination correction, robust similarity measure and regularization. Biomed Opt Express. 2014 Jul 11 ;5(8):2591 -613.
8 Spaide RF, Koizumi H, Pozzoni MC. Enhanced depth imaging spectral-domain optical coherence tomography. Am J Ophthalmol. 2008;146:496-500
9 Hangai M, Yamamoto M, Sakamoto A, Yoshimura N. Ultrahigh-resolution versus speckle noise-reduction in spectral-domain optical coherence tomography. Opt Express. 2009 Mar 2;17(5):4221-35.
10 Romano AC, Belfort. RN., Maia A, Moraes NB, Farah M and Belfort Jr, R. (2009). "En-face, a Novel OCT Imaging Approach to Evaluate Patients With Retinal Diseases." Invest Ophthalmol Vis Sci 50( E-Abstract 341).
11 Lumbroso B, Huang D, Romano A, Coscas G. (2013). "Clinical En Face OCT Atlas." Jaypee Medical Publishers.
12 Matsunaga D, Puliafito CA, Kashani AH. OCT Angiography in Healthy Human Subjects. Ophthalmic Surg Lasers Imaging Retina. 2014;45(6):510-5
13 Hermann B, Fern andez EJ, Unterhuber A, et al. Adaptive-optics ultrahigh-resolution optical coherence tomography. Opt Lett 2004;29:2142-4.
14 Zhang Y, Rha J, Jonnal R, et al. Adaptive optics parallel spectral domain optical coherence tomography for imaging the living retina. Opt Express 2005;13:4792-811.
15 Pircher M, Zawadzki R. Combining adaptive optics with optical coherence tomography: unveiling the cellular structure of the human retina in vivo. Expert Rev Ophthalmol 2007;2:1019-35.
16 Novotny HR, Alvis D. A method of photographing fluorescence in circulating blood of the human eye. Tech Doc Rep SAMTDR USAF Sch Aerosp Med. 1960;60-82:1-4.
17 Klein T, Wieser W, Reznicek L, et al. Multi-MHz retinal OCT. Biomed Opt Express [serial online] 2013;4:1890-908.
18 Capozzi ME, Gordon AY, Penn JS, Jayagopal A. Molecular imaging of retinal disease. J Ocul Pharmacol Ther 2013;29: 275-86.
19 Boisselier E, Astruc D. Gold nanoparticles in nanomedicine: preparations, imaging, diagnostics, therapies and toxicity. Chem Soc Rev 2009;38:1759-1782.
20 Zarbin MA, Montemagno C, Leary JF, Ritch R. Nanomedicine in ophthalmology: the new frontier. Am J Ophthalmol 2010;150:144-62.
21 Grulkowski I, Liu JJ, Potsaid B, et al. Retinal, anterior segment and full eye imaging using ultrahigh speed swept source OCT with vertical-cavity surface emitting lasers. Biomed Opt Express. 2012 Nov 1 ;3(11):2733-51.
Fonte de financiamento: declaram não haver.
Conflito de interesses: declaram não haver.
Recebido em:
24 de Dezembro de 2014.
Aceito em:
30 de Janeiro de 2015.