Rubens Belfort Mattos Neto
DOI: 10.17545/e-oftalmo.cbo/2015.5
RESUMO
OBJETIVO: O melanoma de coroide é o câncer primário intraocular mais comum em adultos. Apesar de relativamente raro segue como causa comum de perda de visão e causa de morte no Brasil, principalmente pelo diagnóstico tardio desse tumor. Este artigo tem como objetivo uma breve revisão das principais características dessa doença, com enfoque em imagens clínicas.
Palavras-chave: Neoplasias da Coroide. Coroide. Úvea.
ABSTRACT
Melanoma is the most common primary intraocular cancer. Relatively rare, choroidal melanoma is a very important cause for vision loss and death in Brazil, probably due to late diagnosis. The purpose of this article is a brief review of choroidal melanoma with particular focus on clinical pictures.
Keywords: Choroid Neoplasms. Choroid. Uvea.
INTRODUÇÃO
O melanoma pode acometer diferentes partes do olho, desde as pálpebras e conjuntiva, até as estruturas internas, como a iris, o corpo ciliar e a coroide. O melanoma de pele e conjuntiva deve ser considerado uma doença diferente do melanoma intraocular, já que apresenta fatores de risco e comportamento diferente do melanoma intraocular. Como exemplo, a exposição ultravioleta é fator de risco importante para o melanoma de pele, mas não para o melanoma de coroide.1,2
O melanoma de coroide é o câncer intraocular primário mais comum nos adultos, com incidência de aproximadamente seis casos por milhão, por ano. Na úvea, o melanoma mais comum é o melanoma de coroide, que é o objetivo desta revisão.
FATORES DE RISCO
Os fatores de risco para o melanoma de coroide incluem raça branca, com cabelos loiros ou ruivos e olhos claros, idade avançada, presença de nevus de coroide ou de melanocitose óculo-dermal (nevus de Ota).3 Apesar de um fator de risco ser o tipo loiro ou ruivo, é importante lembrar que no Brasil vê-se melanoma em pacientes de cabelos escuros e pele mais pigmentada, inclusive negros.
Desses fatores, a presença de nevus e de melanocitose óculo-dermal são importantes para acompanhamento dos pacientes e identificação precoce de melanomas.
Acredita-se que fatores ambientais, como exposição ao sol, não tenham importância como fator de risco para o aparecimento do melanoma intraocular, em oposição aos casos de melanoma de pele, nos quais a exposição ao sol e aos raios UV é fator de risco. Dessa maneira não faz sentido orientar os pacientes a usarem óculos escuros para evitar o melanoma de coroide.4
a) Nevus de coroide
O nevus de coroide é um hamartoma benigno que está presente em parte da população. Pode causar baixa de visão e alterações da retina, mas geralmente é assintomático, plano ou com menos de 1 mm de espessura e base menor que 5mm.5
Nevus estão presentes em cerca de 5% da população, desde o nascimento. Muito raramente essas lesões podem sofrer transformação maligna e dar origem a um melanoma de coroide.6
Foram identificados fatores de risco para crescimento do nevus, que são alterações retinianas secundárias ao crescimento da lesão. Estes fatores de risco incluem presença de líquido sub-retiniano, sintomas, presença de pigmento laranja (lipofuscina), proximidade ao disco óptico, espessura maior que 2 mm, vazio acústico no ultrassom e ausência de halo hipopigmentado ao redor da lesão (figura 1).7
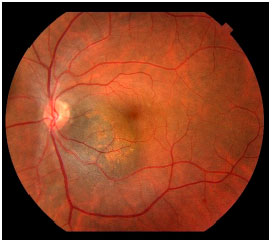
Esses fatores de risco não fecham o diagnóstico de melanoma, mas permitem identificar nevus com maior risco de crescimento e, inclusive, indicar tratamento de alguns nevus com base no risco de crescimento.
O risco anual de um nevus comum sofrer transformação maligna foi estimado na população branca americana como de aproximadamente 1 em 8845.6 É importante reforçar que a imensa maioria dos nevus nunca vai dar origem a um melanoma de coroide.
Os nevus sem fatores de risco devem ser apenas observados, se possível com documentação fotográfica inicial e exame anual. Os nevus com fatores de risco devem ser acompanhados de perto, a cada 3 meses no primeiro ano e depois a cada 6 meses. Nesses casos pode ser útil, além da fotografia, outros exames como ultrassom e tomografia de coerência óptica (OCT). Se houver crescimento deve-se suspeitar de transformação maligna e considerar tratamento.
Lesões com mais de 3mm de espessura são diagnosticadas como melanoma, enquanto as lesões com espessura entre 1 e 3mm podem ser nevus grandes ou melanomas pequenos e, nestes casos, os fatores de risco têm grande importância para o diagnóstico. O crescimento documentado indica que se trata de um melanoma de coroide até que se prove o contrário.
b) Melanocitose óculo-dermal
A melanocitose óculo-dermal é uma doença congênita, caracterizada pelo aumento de pigmentação dos tecidos oculares, associada ou não ao aumento da pigmentação da pele na região do nervo trigêmeo. No caso de pigmentação da pele costuma ser denominada Nevus de Ota, sendo que hoje prefere-se o termo “melanocitose ocular ou óculo-dermal”, dependendo das estruturas hiperpigmentadas (figura 2).
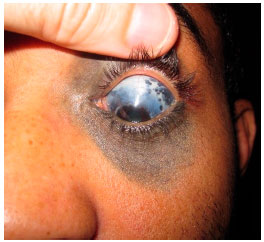
No olho, a melanocitose é observada como aumento de pigmentação da esclera, mas não da conjuntiva. Um teste simples que ajuda a diferenciar é movimentar a conjuntiva com cotonete, permitindo confirmar que o pigmento está na esclera e não mexe com a conjuntiva. Além da esclera, a úvea também costuma apresentar hiperpigmentação, que também pode acometer tecidos da órbita e meninges.
A melanocitose ocular aumenta o risco de melanoma de coroide, que é de 1:400 nesses pacientes. Esses pacientes também apresentam maior risco de glaucoma, dessa maneira além do exame de fundo de olho a cada dois anos, devem ter sua pressão intraocular aferida.3
MELANOMA DE COROIDE
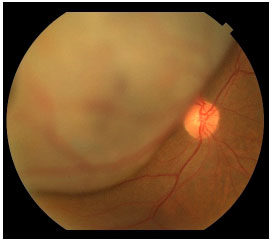
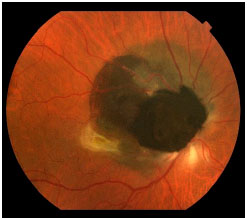
O melanoma de coroide é uma lesão sub-retiniana, geralmente pigmentada e única (figura 3).8 Costuma ser bem delimitada e não costuma estar associada a descolamento de retina extenso ou hemorragia vítrea, com exceções (figura 4).
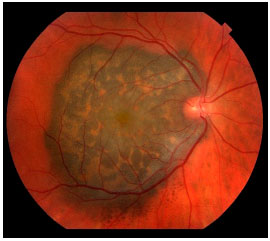
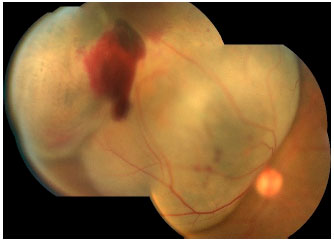
SINTOMAS
Os sintomas que o paciente apresenta vão depender da localização do tumor dentro do olho e de seu tamanho. Se o tumor estiver perto da mácula, o paciente costuma apresentar queixas visuais como embaçamento ou baixa de visão (figura 5), mas se estiver na periferia pode crescer muito até que o paciente perceba alguma alteração.
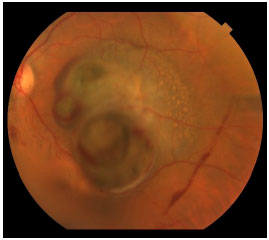
Muitas vezes o tumor é descoberto durante um exame de rotina ou no pré-operatório da cirurgia de catarata e é assintomático. Infelizmente, no Brasil ainda diagnosticamos tumores grandes, principalmente pela dificuldade de acesso a serviços de saúde adequados (figura 6). O exame de fundo de olho com pupilas dilatadas é fundamental em qualquer paciente com queixa de baixa de acuidade visual. Os sintomas incluem moscas volantes, fotopsias e embaçamento / diminuição da acuidade visual.
DIAGNÓSTICO
O exame mais importante para o diagnóstico do melanoma de coroide é o exame de fundo de olho, pela oftalmoscopia indireta, com as pupilas dilatadas. O exame permite que o oftalmologista identifique a lesão sub-retiniana, pigmentada ou não.
A ultrassonografia ocular, associada ao exame de fundo de olho, é fundamental para diagnóstico do melanoma de coroide. Estes dois exames permitem o diagnóstico correto em mais de 90% dos casos. Para isso é importante que o médico examinador identifique a forma da lesão, suas medidas e refletividade durante o exame de ultrassom.
a) Formato da lesão
O modo B permite determinar o formato da lesão, que costuma ser em formato de domo ou cogumelo. A lesão cresce progressivamente e sofre resistência pela membrana de Bruch. Quando a membrana de Bruch rompe, a lesão pode crescer com resistência menor, gerando o aspecto de cogumelo, muito característico de melanoma de coroide, apesar de não ser patognomônico.
b) Medida da lesão
A medida em milímetros permite diferenciar melanomas de nevus, além de permitir determinar qual o melhor tratamento (enucleação ou braquiterapia). A medida também permite acompanhar lesões suspeitas, já que o crescimento confirma o diagnóstico de melanoma.
c) Refletividade interna da lesão
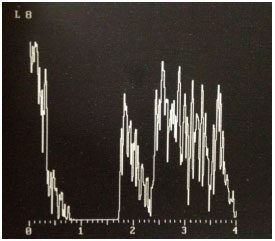
A medida da refletividade no modo A do ultrassom ajuda a confirmar o diagnóstico, já que o melanoma de coroide apresenta refletividade média a baixa, com maior refletividade no ápice da lesão, que vai diminuindo progressivamente com a formação do famoso ângulo Kappa (figura 7). O ultrassom também permite observar escavação coróidea e pode demonstrar vascularização interna da lesão, que são sugestivos de melanoma de coroide.9
Outros exames complementares como tomografia de coerência óptica (OCT) e angiofluoresceína podem ser necessários em casos selecionados.
Quando a lesão é pigmentada e com características clínicas e ultrassonográficas de melanoma, não costuma haver dúvida diagnostica. Nos casos de lesões amelanóticas é importante o diagnóstico diferencial com lesões metastáticas e inflamatorias. Como regra, as metástases podem ser múltiplas ou acometer os dois olhos, além de estarem associadas a descolamento de retina e terem refletividade alta no exame de ultrassom. Nestes casos, deve-se tentar identificar um câncer primário, já que 43% dos pacientes não tem história de câncer quando apresentam a metástase ocular. Os cánceres mais comuns a gerarem metástase ocular são: câncer de mama, pulmão, gastrointestinal, rim, pele e próstata.1^ Se for identificado um câncer primário, trata-se de uma metástase até que se prove o contrário. No caso de não ser identificada lesão primária e com lesão ocular muito sugestiva de metástase deve-se considerar biópsia intraocular.
DIAGNÓSTICO DIFERENCIAL
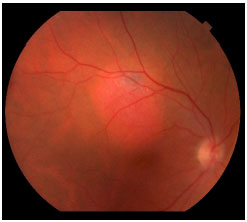
Os diagnósticos diferenciais mais comuns do melanoma de coroide incluem nevus de coroide, hipertrofia congênita do EPR, coriorretinopatia hemorrágica exsudativa periférica, descolamento hemorrágico do EPR, hemangioma circunscrito de coroide (figura 8), melanocitoma (figura 9), degeneração macular relacionada à idade, entre outras.8
ESTAGIAMENTO E DOENÇA METASTÁTICA
O melanoma de coroide é um câncer que pode dar origem a metástases por via hematogênica, geralmente para o fígado. O conteúdo intraocular não apresenta drenagem linfática e por isso não costumamos observar comprometimento de linfonodos, a não ser em casos com extensão extraocular do melanoma (figura 10). Demonstrou-se que desde o momento do diagnóstico pode haver células malignas circulantes no sangue periférico e que todos os pacientes apresentam essas células.11,12 Ainda, não é claro porque alguns pacientes desenvolvem doença metastática, que pode aparecer até uma década depois do tratamento do tumor primário.

Infelizmente, a doença metastática costuma ser fatal em 5 meses, independente do tratamento utilizado.13 A única maneira de diminuir a chance de morte desses pacientes é realizar diagnóstico precoce e tratamento adequado. Quanto maior a lesão, maior a chance de metástase e, apesar de o tratamento da lesão ocular não mudar a história natural da doença, se a lesão não for tratada e crescer, a chance de morte aumenta. Tratamento inadequado em lesão que continua crescendo também aumenta a chance de metástase e morte.
No momento do diagnóstico o paciente é estagiado levando em conta que o principal sítio de metástase é o fígado, seguido dos pulmões. Na grande maioria dos casos o paciente não apresenta metástases no momento do diagnóstico da lesão ocular.13 Esses pacientes são avaliados com exames de imagem e de sangue, que costumam incluir USG ou tomografia computadorizada de abdome e exames de sangue (TGO, TGP, fosfatase alcalina, DHL e Gama-GT).
Costuma-se pesquisar outros tumores primários com raio x ou tomografia de tórax e pelve, além de mamografia para mulheres. Os exames costumam ser repetidos a cada 3 meses, no primeiro ano, e a cada 6 meses, por cinco anos, depois do tratamento. Os exames podem ser solicitados pelo oftalmologista, que encaminha o paciente ao colega oncologista ou hepatologista em caso de alteração no resultado.
Hoje, existem testes genéticos que podem ser realizados no tumor com tecido obtido depois da enucleação ou por biópsia nos tumores tratados com braquiterapia.14 Esses testes genéticos ajudam a determinar o risco de metástase e o prognóstico, mas como ainda não existe tratamento a ser oferecido para pacientes com maior risco de metástase, é controversa a indicação do teste.
TRATAMENTO
O primeiro objetivo no tratamento do melanoma de coroide é salvar a vida do paciente e tal tratamento depende do tamanho do tumor. O melanoma de coroide não é quimiosensível e é pouco rádio-sensível, dessa maneira a quimioterapia sistêmica e a radioterapia por feixe externo não são maneiras eficientes de tratar este tumor.
Apesar de diversos tratamentos estarem descritos para esse tumor, incluindo tratamento com laser e cirurgia para ressecção, dois tratamentos são considerados padrão ouro na atualidade: enucleação e braquiterapia.
a) Enucleação
A enucleação remove o olho com o tumor, permitindo tratamento definitivo da lesão ocular com mínimo risco e custo. Está indicada em tumores grandes (maiores de 9 milímetros de espessura) ou quando a braquiterapia não estiver disponível. Pode-se utilizar esfera de Mules revestida com esclera, além dos tradicionais implantes de polietileno, que costumam ser muito caros no Brasil. A colocação de implante no mesmo tempo cirúrgico permite excelente resultado estético para o paciente, com posterior adaptação de prótese (geralmente seis semanas depois da cirurgia).
Depois da enucleação, o paciente não precisa de retornos freqüentes a centro de maior complexidade com oncologista ocular (como no caso de tratamento com braquiterapia) e deve ser considerada para pacientes que não podem ou não desejam se deslocar até centro com oncologista ocular para acompanhamento.
O olho deve ser enviado para avaliação anátomo-patológica, que confirma o diagnóstico e traz informações adicionais sobre o tumor, além de fatores prognósticos.
b) Braquiterapia
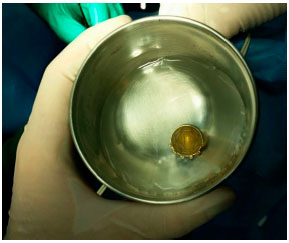
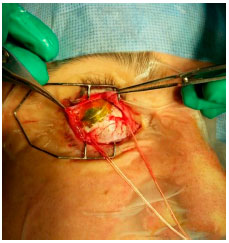
No caso da braquiterapia, um pequeno implante radioativo (figura 11) é colocado do lado de fora do olho, justa escleral, através de uma cirurgia (figura 12).15 A placa de braquiterapia é suturada na esclera depois que sua localização correta é determinada por oftalmoscopia indireta ou transiluminação. Sugerimos a realização de ultrassonografia intraoperatória para confirmar a localização correta da placa (figura 13). A duração do tratamento depende da espessura do tumor e da radioatividade da placa, até que o tumor receba 85Gy em sua ápice. Um segundo procedimento cirúrgico remova a placa.16

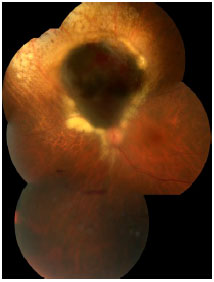
A braquiterapia costuma ser muito eficiente no controle de melanomas de coroide, tratando de maneira adequada 95% das lesões (figura 14). A desvantagem dessa técnica é o alto custo e pouca disponibilidade pelo SUS no Brasil. Complicações da braquiterapia incluem a baixa de visão pela irradiação da retina e nervo óptico, que acomete cerca de 60% dos pacientes depois de dois anos, além de outras menos frequentes.
O paciente é acompanhado com exame oftalmológico e ultrassonografia ocular depois da braquiterapia para confirmar a resposta do tumor ao tratamento. A frequência desse exame varia, mas costuma ser realizado a cada três ou seis meses.
OUTROS TRATAMENTOS
A endoressecão é uma técnica nova, experimental, que remove o tumor através de uma vitrectomia, preservando o olho e possivelmente preservando melhor a visão. Esta técnica está sendo avaliada em centros do Brasil, da Europa e Oriente Médio.
A laserterapia dos melanomas de coroide já foi considerada uma modalidade terapêutica, principalmente com a termoterapia transpupilar (I I I). Hoje, acredita-se que o I I I não é uma maneira adequada de tratar com segurança estes tumores.17 Uma explicação para o bom resultado que alguns autores encontram no tratamento de lesões pequenas é que se tratava de nevus atípicos e não melanomas pequenos.
Estudos científicos sugerem que não existe alteração na mortalidade dos pacientes quando se compara o tratamento de braquiterapia com a retirada do olho (enucleação).18
O tratamento visa controlar o tumor e diminuir a chance de o paciente apresentar metástases, que ainda não são tratáveis na maioria dos casos. Claro que a preservação da visão e do globo ocular também são preocupações importantes, mas a vida do paciente é a prioridade número um.
ACOMPANHAMENTO
Os pacientes com melanoma ocular são acompanhados pelo oftalmologista especializado em tumores. Sabe-se que nos primeiros cinco anos após tratamento existe maior chance de o paciente desenvolver metástases. Nos últimos anos o tratamento do melanoma de pele melhorou e espera-se que em breve o tratamento das metástases do melanoma de coroide também melhore, com aumento da sobrevida dos pacientes.
REFERÊNCIAS
1 Schwartz LH, Ferrand R, Boelle PY, Maylin C, D’Hermies F, Virmont J. Lack of correlation between the location of choroidal melanoma and ultraviolet-radiation dose distribution. Radiat Res. 1997;147(4):451-456. http://dx.doi.org/10.2307/3579502.
2 Moan J, Grigalavicius M, Baturaite Z, Dahlback A, Juzeniene A. The relationship between UV exposure and incidence of skin cancer. Photodermatol Photoimmunol Photomed. 2015;31(1):26-35. http://dx.doi.org/10.1111/phpp.12139.
3 Shields CL, Kaliki S, Livesey M, Walker B, Garoon R, Bucci M, Feinstein E, Pesch A, Gonzalez C, Lally SE, Mashayekhi A, Shields JA. Association of ocular and oculodermal melanocytosis with the rate of uveal melanoma metastasis: analysis of 7872 consecutive eyes. JAMA Ophthalmol. 2013;131(8):993-1003. http://dx.doi.org/10.1001/iamaophthalmol.2013.129.
4 Pane AR, Hirst LW. Ultraviolet light exposure as a risk factor for ocular melanoma in Queensland, Australia. Ophthalmic Epidemiol. 2000;7(3):159-167. http://dx.doi.org/10.1076/0928-6586(200009)731-VFT159.
5 Singh AD, Belfort RN, Sayanagi K, Kaiser PK. Fourier domain optical coherence tomographic and auto-fluorescence findings in indeterminate choroidal melanocytic lesions. BrJ Ophthalmol. 2010;94(4):474-478. http://dx.doi.org/10.1136/bjo.2009.162636.
6 Singh AD, Kalyani P, Topham A. Estimating the risk of malignant transformation of a choroidal nevus. Ophthalmology. 2005;112(10): 1784-1789. http://dx.doi.org/10.1016/j.ophtha.2005.06.011.
7 Shields CL, Furuta M, Berman EL, Zahler JD, Hoberman DM, Dinh DH, Mashayekhi A, Shields JA. Choroidal nevus transformation into melanoma: analysis of 2514 consecutive cases. Arch Ophthalmol. 2009;127(8): 981-987. http://dx.doi.org/10.1001/archophthalmol.2009.151.
8 Shields CL, Manalac J, Das C, Ferguson K, Shields JA. Choroidal melanoma: clinical features, classification, and top 10 pseudomelanomas. Curr Opin Ophthalmol. 2014;25(3):177-185. http://dx.doi.org/10.1097/ICU.0000000000000041.
9 Rochéis R. [The origin of the choroidal excavation in b-scan-sonography--an experimental and clinical study (author’s transi)].” Albrecht Von Graefes Arch Klin Exp Ophthalmol. 1981 ;217(3):193-197. http://dx.doi.org/10.1007/BF00411150.
10 Shields CL, Shields JA, Gross NE, Schwartz GP, Lally SE. Survey of 520 eyes with uveal métastasés. Ophthalmology. 1997;104(8):1265-1276. http://dx.doi.org/10.1016/S0161-6420(97)30148-1.
11 Callejo SA, Antecka E, Blanco PL, Edelstein C, Burnier Jr MN. Identification of circulating malignant cells and its correlation with prognostic factors and treatment in uveal melanoma. A prospective longitudinal study. Eye (Lond). 2007; 21(6):752-759. http://dx.doi.org/10.1038/sj.eye.6702322.
12 Fernandes BF, Belfort RN, Di Cesare S, Burnier Jr MN. Circulating uveal melanoma cells: should we test for them? Can J Ophthalmol. 2008;43(2):155-158. http://dx.doi.org/10.3129/i08-011.
13 Cerbone L, Van Ginderdeuren R, Van den Oord J, Fieuws S, Spileers W, Van Eenoo L, Wozniak A, Sternberg ON, Schoffski P. Clinical presentation, pathological features and natural course of metastatic uveal melanoma, an orphan and commonly fatal disease. Oncology. 2014;86(3):185-189. http://dx.doi.org/10.1159/000358729.
14 Onken MD, Worley LA, Char DH, Augsburger JJ, Correa ZM, Nudleman E, et al. Collaborative Ocular Oncology Group report number 1 : prospective validation of a multi-gene prognostic assay in uveal melanoma. Ophthalmology. 2012;119(8):1596-1603. http://dx.doi.org/10.1016/j-ophtha.2012.02.017.
15 Giblin ME, Shields JA, Augsburger JJ, Brady LW. Episcleral plaque radiotherapy for uveal melanoma. Aust N Z J Ophthalmol.1989;17(2):153-156. http://dx.doi.org/10.1111/j.1442-9071.1989.tb00505.x.
16 Shields JA, Shields CL. Management of posterior uveal melanoma: past, present, and future: the 2014 Charles L. Schepens lecture. Ophthalmology. 2015;122(2):414-428. http://dx.doi.org/10.1016/j.ophtha.2014.08.046.
17 Mashayekhi A, Shields CL, Rishi P, Atalay HT, Pellegrini M, McLaughlin JP, et al. Primary transpupillary thermotherapy for choroidal melanoma in 391 cases: importance of risk factors in tumor control. Ophthalmology. Forthcoming, 2014. http://dx.doi.org/10.1016/j-ophtha.2014.09.029.
18 Margo CE. The collaborative ocular melanoma study: an overview. Cancer Control. 2004;11(5):304-309.

Fonte de financiamento: declaram não haver.
Conflito de interesses: declaram não haver.
Recebido em:
15 de Janeiro de 2015.
Aceito em:
30 de Janeiro de 2015.