Daniel Caiado Fraga Lavagnoli1; Kássio Assis1; Patrícia Grativol Costa Saraiva1; Fábio Petersen Saraiva1; Luiz Guilherme Marchesi Mello1,2
DOI: 10.17545/eOftalmo/2023.0051
RESUMO
A membrana amniótica humana possui grande potencial terapêutico por suas características anti-inflamatórias, antimicrobianas e antiangiogênicas. Na Oftalmologia, seu uso está consolidado para o tratamento de lesões agudas e crônicas da superfície ocular, como defeitos corneanos persistentes e descemetocele, e até mesmo em cirurgias eletivas, como a exérese de pterígio. O processo de obtenção da membrana amniótica para uso oftalmológico possui diversas etapas, que incluem a triagem clínica da doadora, captação da placenta com as membranas amniótica e coriônica, processamento, armazenamento e o monitoramento da qualidade da membrana amniótica. Assim, faz-se necessário o desenvolvimento de um protocolo a servir como orientação para a produção de enxertos de membrana amniótica preservando suas características terapêuticas e reduzindo os riscos inerentes ao seu uso em pacientes receptores. Apresentamos neste artigo um protocolo operacional padrão para captação, preparo e preservação da membrana amniótica para uso oftalmológico, de modo a possibilitar a reprodutibilidade segura deste processo.
Palavras-chave: Protocolos, Bancos de Tecidos; Membranas Extraembrionárias; Obtenção de Tecidos e Órgãos; Ferimentos e Lesões.
ABSTRACT
Human amniotic membranes have great therapeutic potential owing to their anti-inflammatory, antimicrobial, and antiangiogenic characteristics. In ophthalmology, their use is well established for treating acute and chronic lesions of the ocular surface, such as persistent corneal defects and descemetocele, and even in elective surgeries such as pterygium excision. The process of obtaining amniotic membranes for ophthalmic use involves several steps, including clinically screening the donor, retrieving the placenta along with the amniotic and chorionic membranes, and processing, storing, and monitoring the amniotic membrane quality. Thus, it is necessary to develop a protocol to serve as a guideline for producing amniotic membrane grafts, preserving their therapeutic characteristics and reducing the risks inherent to their use in recipient patients. This study presents a standard operating protocol for procuring, preparing, and preserving amniotic membranes for ophthalmic use to enable the safe reproducibility of this process.
Keywords: Protocols; Tissue banks; Extraembryonic membranes; Tissue and organ procurement; Wounds and injuries.
INTRODUÇÃO
A placenta é um órgão efêmero materno-fetal, que possui diversas funções, destacando-se a troca de nutrientes da mãe para o feto e a eliminação de metabólitos fetais. Quatro diferentes estruturas membranosas estão envolvidas no desenvolvimento placentário do ser humano: o córion, o âmnio, o saco vitelino e o alantoide1. Durante o desenvolvimento fetal, o âmnio ou membrana amniótica (MA), possui a função da proteção fetal contra estresse mecânico e desidratação. Contudo, também podem ser destacadas outras propriedades importantes como: as ações anti-inflamatória, antimicrobiana e antiangiogênica2. Além disso, possui como propriedade uma imunogenicidade reduzida, contribuindo para sua aplicabilidade como enxerto.
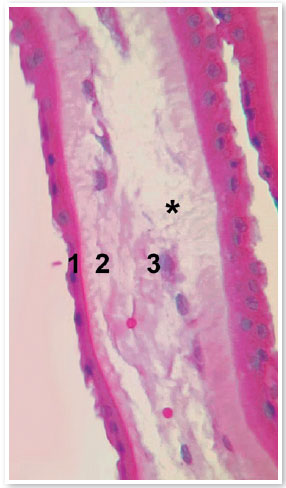
A MA possui entre 0,02 e 0,5 mm de espessura total, sendo composta por cinco camadas distintas: epitélio, membrana basal, camada compacta, camada de fibroblastos e camada esponjosa (Figura 1)3. Ela foi utilizada pela primeira vez com finalidade terapêutica em 1910, mas somente 30 anos depois seu uso foi descrito na Oftalmologia, para o tratamento de simbléfaro2. Atualmente, existem estudos sugerindo o benefício do uso da MA em diversas doenças oftalmológicas além do simbléfaro, como: queimaduras, síndrome de Stevens Johnson, necrose epidérmica tóxica, perfurações e afinamentos corneanos (por exemplo, descemetoceles, úlcera neurotrófica, defeitos epiteliais), ceratopatia bolhosa, ceratopatia em faixa, insuficiência límbica, reconstrução conjuntival, esclerite, enxerto no tratamento de pterígio, tumores da superfície ocular e em cirurgias fistulizantes. Para que a MA possa ser utilizada, é necessária a realização de processos de preparo e armazenamento que objetivam a descontaminação do material e promoção de um ambiente o mais inerte possível em que o tecido possa ser conservado e suas propriedades mantidas. Há diferentes métodos de preservação como a desidratação, liofilização, reticulação química e criopreservação, que podem interferir na estrutura tecidual da MA e influenciar no seu processo de degeneração e no sucesso do tratamento4. Um estudo recente concluiu que a MA criopreservada é comparável à MA fresca no que diz respeito à integridade estrutural e retenção de componentes bioquímicos essenciais para funções biológicas, indicando que a criopreservação oferece um meio seguro e eficaz de preservação5.
Considerando a importância do estabelecimento de métodos padronizados para a obtenção da MA pronta para uso em procedimentos oftalmológicos, foi desenvolvido um protocolo operacional padronizado que estabelece fluxos e métodos para a captação, processamento e armazenamento de membrana amniótica.
MÉTODOS
Foram revisadas as normativas nacionais e recomendações internacionais de aplicabilidade da membrana amniótica humana na Oftalmologia, bem como a captação, preparo e armazenamento deste tecido, por meio de artigos científicos publicados no Pubmed, Scielo e Lilacs e legislação vigente, até 31 de outubro de 2022, utilizando as palavras-chave em português e inglês: membrana amniótica, âmnio, transplante, preservação, bancos de tecidos e banco de olhos. A partir desses dados, foi desenvolvido um protocolo operacional para garantir o cumprimento de boas práticas clínicas, terapêuticas e organizacionais.
RESULTADOS
Atribuições, competências e responsabilidades
O processo de captação e preparo do tecido, para estar apto ao uso, é feito de forma multidisciplinar, envolvendo a equipe de Médica e de Enfermagem do Banco de Olhos do serviço de Oftalmologia, do serviço de Ginecologia e Obstetrícia, do serviço de Patologia e do serviço de Microbiologia, conforme fluxograma descrito na Figura 2 e detalhado a seguir.
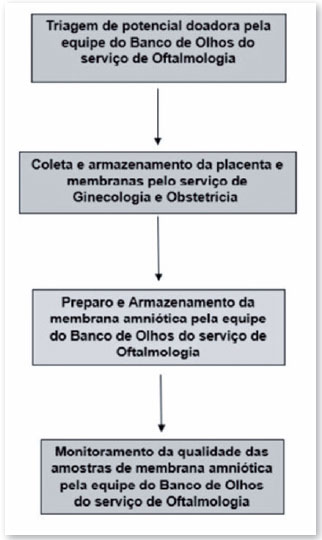
Etapas
1. Triagem de potencial doadora pela equipe do Banco de Olhos do serviço de Oftalmologia
1.1. Identificar uma possível doadora: puérperas maiores de 18 anos internadas na enfermaria de Obstetrícia (eleita aos critérios de inclusão) e que não possuam nenhum dos critérios de exclusão. Segundo o Regulamento Técnico do Sistema Nacional de Transplantes, Portaria Nº 2.600 - 28/10/20096-9, e pelos critérios do Banco de Olhos do Hospital Universitário Cassiano Antônio Moraes da Universidade Federal do Espírito Santo (UFES), foram construídos as contraindicações absolutas a uma candidata à doação. São eles:
a) Sepse em atividade;
b) Endocardite (bacteriana ou fúngica) em atividade;
c) Linfomas ativos disseminados;
d) Leucemias;
e) Evidência clínica ou laboratorial de infecção por HIV, hepatite B ou C;
f) Risco de transmissão de enfermidades causadas por príons: Doença de Creutzfeltd Jakob, doença neurológica de etiologia viral ou indeterminada, panencefalite subaguda esclerosante, encefalite viral ativa, encefalite de origem desconhecida, encefalopatia progressiva ou leucoencefalopatia multifocal progressiva;
g) Raiva;
h) Rubéola congênita;
i) Síndrome de Reye;
j) Meningite;
k) Colonização por bactérias multirresistentes;
l) Intoxicações a agrotóxicos;
m) Leptospirose;
n) Dengue em fase febril ou crítica;
o) Malária;
p) Encefalite herpética;
q) Câncer em localização com maior probabilidade de produzir metástase (mama, pulmão, fígado, linfoma e leucemias, melanoma cutâneo e pâncreas);
r) As seguintes doenças em atividade: câncer uterino, de colo de útero ou de canal vaginal, endometriose, endometrite, doença inflamatória pélvica, infecção intrauterina ou de canal vaginal pelo vírus do papiloma humano (HPV);
1.2. Abordagem e Acolhimento da gestante para o processo de doação da placenta.
Etapa vital que necessita de responsabilidade, respeito e cuidado para realizar a entrevista. De fato, isso se faz importante, pois o questionário apresentado à gestante investiga fatos pessoais, íntimos e comportamentais, necessitando dessa forma de um ambiente confortável para respondê-lo.
Entregar o Termo de Doação de Tecido Placentário (Figura 3), coletando assinaturas nas três vias. A primeira via será anexada ao prontuário médico, a segunda via será anexada ao prontuário de doação no Banco de Olhos e a terceira via será fornecida para a potencial doadora. A recusa em assinar o Termo de Doação de Tecido Placentário será considerada critério de exclusão.
1.3. Proceder a identificação dos dados iniciais da doadora de MA (Figura 4), com nome, idade, hora da dequitação placentária, número do prontuário e familiares presentes;
1.4. Preencher a ficha de triagem clínica (Figura 5). O não preenchimento de todos os critérios obrigatórios impossibilitará a utilização do tecido doado, devendo este ser descartado em local apropriado:
a) Parto a menos de 24 horas do dia a ser confeccionado o enxerto (critério obrigatório);
b) Sem história de abuso de álcool, fumo ou drogas (critério obrigatório);
c) Sem história de múltiplos parceiros nos últimos 9 meses (critério obrigatório);
d) Avaliação dos exames de triagem do pré-natal (cartão da gestante), sendo excluída deste protocolo caso apresente algum destes exames positivos: HBsAg, Anti-HBc IgM e IgG, Anti-HCV, Anti-HIV-1, anti-HIV-2, VDRL, HTLV 1 e 2, CMV igM e IgG, Toxo IgM e IgG, (critério obrigatório);
e) Preferencialmente partos a termo sem comorbidades associadas confirmadas ou suspeitas (Descolamento Prematuro de Placenta, Parto Prematuro, Crescimento Intrauterino Restrito, Malformações, Infecções venéreas ou congênitas, Mecônio durante parto, Sofrimento Fetal Agudo ou Crônico, Ruptura Prematura de Membranas, Endometrite) (critério facultativo).
1.5. Coletar amostras de sangue da doadora e preencher a ficha de triagem laboratorial (Figura 4). A positividade para um (ou mais) dos exames impossibilitará a utilização do tecido doado, devendo este ser descartado em local apropriado.
2. Coleta e armazenamento da placenta e membranas pelo serviço de Ginecologia e Obstetrícia
• Higienizar as mãos conforme procedimento operacional padrão do Serviço de Controle de Infecção Hospitalar;
• Após dequitação placentária, estando devidamente paramentado com equipamento de proteção individual (óculos, máscara e luva estéril), colocar a placenta e membranas de uma potencial doadora em um saco coletor;
• Fechar e identificar o saco coletor com nome completo e número de prontuário da parturiente;
• Armazenar o saco coletor por até 24h (a contar a partir do horário do parto) em um ambiente com temperatura controlada entre 2ºC e 8ºC;
• Descartar em local apropriado o saco coletor que ficou armazenado por mais de 24h.
3. Preparo da membrana amniótica pela equipe do Banco de Olhos do serviço de Oftalmologia
3.1 Após identificação de uma doadora, preenchimento de toda a documentação e autorização para uso da membrana amniótica, transportar o saco coletor identificado contendo a placenta e membranas placentárias diretamente para o Banco de Olhos em caixa isotérmica em temperatura interior de 2 a 8 ºC.
3.2. Separação e preparo inicial da membrana amniótica
• Higienizar as mãos conforme protocolo da unidade;
• Paramentar-se com equipamento de proteção individual (óculos, touca, máscara, capote estéril e luva estéril) e distribuir os campos estéreis na área de trabalho;
• Separar o conjunto membrana amniótica e membrana coriônica do restante da placenta com tesoura estéril, mantendo a face epitelial da membrana amniótica (face interna das membranas) sempre voltada para cima;
• Devolver o restante da placenta para o saco coletor;
• Lavar de forma abundante a membrana amniótica e córion com solução fisiológica de ringer lactato;
• Separar manualmente a membrana coriônica da membrana amniótica e colocar o córion junto ao restante da placenta em saco coletor para o descarte adequado do material;
• Dispor duas cubas e preenchê-las com a solução 1 (preparo da solução 1 conforme arquivo suplementar "Descritivo das soluções 1 e 2");
• A membrana amniótica é dividida em duas partes, sendo cada uma colocada em uma cuba/bacia estéril e irrigada abundantemente com ringer lactato estéril para remoção manual e mecânica de sangue e debris, trocando o ringer lactato de acordo com a necessidade;
• Colocar as membranas limpas nas cubas contendo a solução 1 (Figura 6), e aguardar 30 minutos;
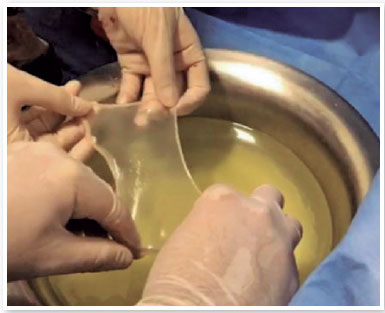
• Retirar as luvas e capote estéril;
• Higienizar as mãos.
3.3. Preparo final das amostras de membrana amniótica em capela de fluxo laminar para armazenamento
• Higienizar as mãos conforme protocolo padrão da unidade;
• Higienizar a capela de fluxo laminar antes de manipulá-la conforme protocolo padrão da unidade;
• Separar os frascos estéreis de conservação da membrana amniótica (Figura 7), de acordo com o modo de preservação que as membranas estarão;
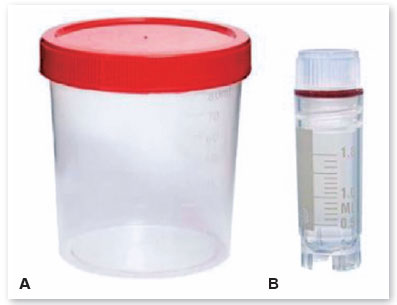
OBS: O frasco estéril selecionado é de acordo com a temperatura do local em que ele será preservado. Os destinados para temperaturas de 2 a 8º são feitos de polipropileno ou polietileno, com tampa de rosca simples, já os feitos para suportar temperaturas de até - 85 º, são feitos de polipropileno reforçado, com tampa acoplada, fechamento hermético e duplo lacre.
• Higienizar as mãos conforme protocolo da unidade;
• Paramentar-se com EPI, capote estéril e luva estéril e distribuir os campos estéreis na área de trabalho na capela de fluxo laminar
• Introduzir os frascos de conservação da membrana amniótica na capela de fluxo laminar, abri-lo e colocá-lo na área estéril;
• Organizar sobre a bancada da capela o material estéril a ser utilizado e abri-lo de forma a não o contaminar, com auxílio de um ajudante que não esteja paramentado, bem como os outros materiais de consumo a serem utilizados;
• Dispor sobre o campo impermeável estéril o papel de nitrocelulose, pinças, tesoura e bisturi;
• Dispor sobre o papel de nitrocelulose a membrana amniótica com a face epitelial voltada para cima;
• Iniciar o corte dos pedaços de 2,5 x 2,5 cm (Figura 8) e colocar cada pedaço de membrana amniótica com o papel de nitrocelulose em um frasco de conservação contendo 10 ml da solução 2 (preparo da solução 2 conforme arquivo suplementar "Descritivo das soluções 1 e 2");
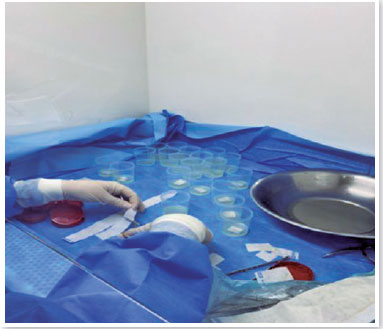
• Colocar um pedaço de membrana amniótica em um tubo contendo BHI (Brain Heart Infusion) e encaminhar para o serviço de Microbiologia (para pesquisa de fungos, bactérias e germes inespecíficos, bacterioscopia e antibiograma), incubando por até 15 dias;
• Enviar para análise no setor de Patologia um frasco contendo uma amostra de membrana amniótica, assim como o saco coletor contendo a placenta e a membrana coriônica;
• Desprezar as lâminas na caixa específica para material perfurocortante;
• Retirar os materiais da capela após o término do procedimento e encaminhá-los ao expurgo;
• Retirar EPIs;
• Higienizar as mãos conforme protocolo padrão da unidade;
• Calçar luva de procedimentos;
• Identificar os frascos de conservação das membranas amnióticas com etiqueta contendo: identificação do produto (membrana amniótica e tamanho), número do prontuário de doação no Banco de Olhos, nome do responsável pelo preparo, temperatura de armazenamento, data do preparo, data de validade da membrana amniótica (2ºC a 8ºC: 3 meses; -75 e -85ºC: 2 anos) (10) (11); e lacrar os frascos;
• Manter os frascos refrigerados em geladeira (2ºC a 8ºC) ou em freezer ( -80 Cº).
4. Monitoramento da qualidade das amostras de membrana amniótica pela equipe do Banco de Olhos do serviço de Oftalmologia
Após o preparo e armazenamento das amostras de membrana amniótica, é necessário o monitoramento mensal dos lotes por meio de inspeção visual externa e envio de uma amostra para análise microbiológica e histopatológica. Dessa forma o material só continuará sendo liberado para uso se não apresentar alteração à inspeção visual externa, sinais de infecção no exame microbiológico e histopatológico ou sinais de necrose tecidual avançada no exame histopatológico. O resultado dessas análises deverá ser armazenado no prontuário de doação no Banco de Olhos, mediante preenchimento da ficha de monitoramento da qualidade das amostras (Figura 9).
Caso seja identificado algum problema com a membrana fornecida para uso, o médico que a utilizou deverá notificar o Banco de Olhos por escrito sobre o problema ocorrido e o fornecimento de amostras daquele lote será paralisado até que a situação seja averiguada com o responsável técnico pelo Banco de Olhos, que definirá se as amostras serão descartadas ou mantidas para uso. Os dados deverão ser anotados no prontuário de doação no Banco de Olhos.
DISCUSSÃO
A realidade dos serviços oftalmológicos no Brasil no que diz respeito ao uso da membrana amniótica ainda é limitada aos grandes centros de pesquisa e universidades. Parte desse cenário se deve à estrutura hospitalar e laboratorial necessária para possibilitar a captação, processamento, armazenamento, monitorização e aplicação do material nos pacientes indicados. Visto isso, é de extrema importância que resoluções como a conferida pela Diretoria Colegiada da Agência Nacional de Vigilância Sanitária RDC Nº 55, DE 11 DE DEZEMBRO DE 20158, sejam formuladas com o intuito de padronizar os Bancos de Tecidos. Dessa forma, são estabelecidos requisitos técnico-sanitários mínimos para o seu funcionamento, visando à segurança e qualidade dos tecidos fornecidos para uso terapêutico8, de modo a possibilitar que novos centros possam ser formados e mais pessoas possam usufruir desse recurso.
É notório observar que um processo com tantas etapas precisa de uma equipe multidisciplinar coesa, formada por profissionais treinados e capacitados, que atuarão desde o momento de triagem clínico e laboratorial da gestante até o monitoramento da amostra para liberação do uso do material4. Tão importante quanto o recurso humano no processo, é imprescindível o acesso a uma estrutura adequada para o armazenamento correto do material, um laboratório para análise anatomopatológica e um laboratório para pesquisa de possíveis microrganismos contaminantes da membrana. Dessa forma, é possível produzir um enxerto cirúrgico com boa qualidade estrutural e com poucos riscos de contaminação para ser utilizado em benefícios de pacientes com doenças oftalmológicas. Além disso, a preservação e o armazenamento a longo prazo de materiais biológicos, não só oferece a vantagem de boa disponibilidade por um maior período, mas também reduz o risco de transmissão de doenças10,11.
O uso da membrana amniótica na Oftalmologia é uma das principais opções terapêuticas para doenças da superfície ocular refratárias à terapia clínica, especialmente as que envolvem alterações no processo de cicatrização e da barreira física ocular. Até o presente momento, ainda não foi publicado na literatura científica um artigo orientando a coleta, preparo, armazenamento e monitoramento das amostras de membrana amniótica humana conforme normas brasileiras e padrões internacionais de qualidade. O desenvolvimento de um protocolo clínico como descrito neste artigo é essencial para garantir a qualidade das amostras de membrana amniótica, diminuir os riscos aos pacientes e difundir o uso deste tecido na prática oftalmológica diária.
REFERÊNCIAS
1. Brolio MP, Ambrósio CE, Franciolli AR, Morini AC, Guerra RR, Miglino MA. A barreira placentária e sua função de transferência nutricional. Rev Bras Reprod Anim. 2010;34(4):222-232.
2. Alió JL, Abad M, Scorsetti DH. Preparation, indications and results of human amniotic membrane transplantation for ocular surface disorders. Expert Rev Med Devices. 2005;2(2):153-60.
3. Fairbairn NG, Randolph MA, Redmond RW. The clinical applications of human amnion in plastic surgery. J Plast Reconstr Aesthet Surg. 2014;67(5):662-75.
4. 4Jirsova K, Jones GLA. Amniotic membrane in ophthalmology: properties, preparation, storage and indications for grafting-a review. Cell Tissue Bank. 2017;18(2):193-204.
5. Hettiarachchi D, Dissanayake VH, Goonasekera HW. Optimizing amniotic membrane tissue banking protocols for ophthalmic use. Cell Tissue Bank. 2016;17(3):387-97.
6. Saúde Md. PORTARIA Nº 2.600, DE 21 DE OUTUBRO DE 2009 Aprova o Regulamento Técnico do Sistema Nacional de Transplantes. In: Ministro Gd, editor. Diário Oficial da União 2009.
7. Saúde Md. PORTARIA DE CONSOLIDAÇÃO Nº 4, DE 28 DE SETEMBRO DE 2017 Consolidação das normas sobre os sistemas e os subsistemas do Sistema Único de Saúde. In: Ministro Gd, editor. Diário Oficial da União 2017.
8. Colegiada D. RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 55, DE 11 DE DEZEMBRO DE 2015. In: Sanitária ANdV, editor. Diário Oficial da União 2015.
9. Saúde Md. RESOLUÇÃO Nº 67, DE 30 DE SETEMBRO DE 2008. In: Sanitária ANdV, editor. Diário Oficial da União 2008.
10. Maral T, Borman H, Arslan H, Demirhan B, Akinbingol G, Haberal M. Effectiveness of human amnion preserved long-term in glycerol as a temporary biological dressing. Burns. 1999;25(7):625-35.
11. Dua HS, Gomes JA, King AJ, Maharajan VS. The amniotic membrane in ophthalmology. Surv Ophthalmol. 2004;49(1):51-77.
| INFORMAÇÃO DOS AUTORES |
|
 |
» Daniel Caiado Fraga Lavagnoli https://orcid.org/0000-0002-2783-3753 http://lattes.cnpq.br/7138201543100306 |
 |
» Kássio Assis https://orcid.org/0000-0002-0226-1816 http://lattes.cnpq.br/9733413369910165 |
 |
» Luiz Guilherme Marchesi Mello https://orcid.org/0000-0001-8347-2393 http://lattes.cnpq.br/0620671396588526 |
 |
» Patrícia Grativol Costa Saraiva https://orcid.org/0000-0002-1083-9980 http://lattes.cnpq.br/8944400266170157 |
 |
» Fábio Petersen Saraiva https://orcid.org/0000-0002-1196-8872 http://lattes.cnpq.br/4779368875052793 |
Financiamento: Declaram não haver.
Conflitos de Interesse: Declaram não haver.
Recebido em:
17 de Maio de 2023.
Aceito em:
22 de Outubro de 2023.