Thaissa Faloppa Duarte; Rubens Camargo Siqueira
DOI: 10.17545/eOftalmo/2023.0025
RESUMO
A disfunção da glândula meibomiana é uma anormalidade crônica caracterizada por obstrução do ducto terminal e/ou alterações qualitativas e quantitativas na secreção glandular, podendo resultar em alteração do filme lacrimal, sintomas de irritação ocular, inflamação clinicamente aparente e doença da superfície ocular, que podem acarretar grandes prejuízos visuais e de qualidade de vida. Fatores oftalmológicos, sistêmicos e relacionados com medicações podem coexistir ou contribuir para a patogênese dessa disfunção, contribuindo no prognóstico e estabilização da doença. Seu diagnóstico e tratamento são essencialmente clínicos. Neste artigo de revisão são descritos aspectos clínicos e diagnósticos de pacientes com disfunção da glândula meibomiana.
Palavras-chave: Disfunção da glândula meibomiana; Doenças sistêmicas; Oftalmologia.
ABSTRACT
Meibomian gland dysfunction is a chronic, multifactorial abnormality characterized by obstruction of the terminal duct and/or qualitative and quantitative changes in glandular secretion that results in a change in the tear film, symptoms of eye irritation, clinically apparent inflammation and ocular surface disease and can cause vision impairment, reducing quality of life. Ophthalmological, systemic and medication-related factors can coexist or contribute to the pathogenesis of this dysfunction, contributing to the prognosis and stabilization of the disease. Diagnosis and treatment are essentially clinical. The present review article describes clinical and diagnostic aspects of meibomian gland dysfunction.
Keywords: Meibomian gland dysfunction; Systemic diseases; Ophthalmology.
INTRODUÇÃO
A disfunção da glândula meibomiana (DGM) é anormalidade crônica e difusa das glândulas meibomianas, comumente caracterizada por obstrução do ducto terminal e/ou alterações qualitativas e quantitativas na secreção glandular, podendo resultar em alteração do filme lacrimal, sintomas de irritação ocular, inflamação clinicamente aparente e doença da superfície ocular1.
Descrita pelo médico alemão Heinrich Meibom em 1666, as glândulas de Meibomius são glândulas sebáceas modificadas localizadas nas placas tarsais das pálpebras superiores e inferiores. Essas glândulas sintetizam e produzem ativamente lipídios e proteínas que se espalham no filme lacrimal, promovendo sua estabilidade ao diminuir a tensão superficial e evitando evaporação da fase aquosa. Cada glândula meibomiana consiste em vários ácinos secretores contendo meibócitos, dúctulos laterais, ducto central e ducto excretor terminal que se abre na margem posterior da pálpebra. A liberação de sua secreção (meibum) para a pálpebra ocorre com a contração muscular durante o movimento da pálpebra. Essas glândulas são densamente inervadas e sua função é regulada por androgênios, estrogênios, progesterona, ácido retinoico e fatores de crescimento e, provavelmente, por neurotransmissores1,2.
Neste artigo de revisão são apresentados aspectos clínicos e diagnósticos de pacientes com disfunção da glândula meibomiana. Além disso, discute-se a abordagem terapêutica multidisciplinar na ocorrência dessa disfunção em pacientes com enfermidades sistêmicas.
Epidemiologia
A frequência de ocorrência da DGM varia de 3,5 a 70%3-15, sendo elevada em populações asiáticas (46,2 a 69,3%) e mais comum em homens4-6. Em contraste, em caucasianos varia de 3,5 a 19,9%, mais comum em mulheres3. É consenso que essa frequência aumenta com a idade. No Brasil, a DGM apresenta frequência de ocorrência entre 37,0 e 50,0%, acometendo mais indivíduos acima de 50 anos e do sexo feminino16-18.
Etiologia
A DGM pode ser dividida em duas categorias com base na secreção das glândulas meibomianas: estados de baixa secreção e de alta secreção. Os estados de baixa secreção são classificados como hiposecretor obstrutivo, podendo ser cicatricial ou não-cicatricial17-19. A DGM hiposecretora refere-se à secreção reduzida causada por anomalias nas glândulas meibomianas sem obstrução significativa, em geral decorrente de obstrução do ducto terminal. Na forma cicatricial, os orifícios do ducto são arrastados posteriormente para a mucosa, o que se conhece por conjuntivalização da margem palpebral, importante para detectar o tipo cicatricial da meibomite crônica, enquanto esses mesmos orifícios permanecem em sua posição normal na DGM não-cicatricial.
Alterações histopatológicas incluem hipertrofia e queratinização do epitélio do orifício. A baixa secreção é causada por obstrução glandular devido à obstrução do ducto terminal e estase de secreção, o que proporciona dilatação cística intraglandular, atrofia acinar e, consequente, diminuição da secreção lipídica. Esse distúrbio é observado em indivíduos idosos por toxicidade a medicações tópicas e sistêmicas, como por exemplo, uso de ácido retinoico sistêmico e uso crônico de lentes de contato1,2. A insuficiência androgênica ou a falta de receptores androgênicos também está associada à queratinização, obstrução e alteração das secreções das glândulas meibomianas. As causas da DGM obstrutiva cicatricial incluem tracoma, penfigoide cicatricial ocular, eritema multiforme e doença ocular atópica. A DGM obstrutiva não cicatricial pode ser observada na síndrome de Sjögren, dermatite seborreica, acne rosácea, atopia e psoríase. É bem conhecido que bactérias comensais, como estafilococos coagulase-negativos, Staphylococcus aureus e Propionibacterium acnes contribuem para o agravamento clínico da doença, cujas enzimas levam à liberação de produtos de degradação lipídica, como ácidos graxos livres, que ativam a liberação da cascata inflamatória, estimulando assim, o agravamento da queratinização.
A DGM hipersecretória é caracterizada pela liberação de grande volume de lipídio meibomiano na margem palpebral em resposta à pressão no tarso. Esta pode ser primária ou idiopática ou secundária a enfermidades dermatológicas, como por exemplo, dermatite seborreica, dermatite atópica e acne rosácea1,2,20-24.
Como resultado, há aumento da evaporação da lágrima, hiperosmolaridade, instabilidade e deficiência de umectação com irritação mecânica que estimula o início de cascatas inflamatórias na superfície ocular e proliferação bacteriana na margem palpebral, o que intensifica inflamação da superfície ocular6,18,25-27.
Fatores de Risco
Existem diversos fatores oftalmológicos, sistêmicos e relacionados com medicação que podem coexistir ou contribuir para patogênese da DGM.
Fatores oftalmológicos incluem uso crônico de lentes de contato, infestação por Demodex folliculorum, síndrome da pálpebra frouxa, conjuntivite papilar gigante, ictiose, degeneração corneana de Salzmann, tracoma e doença do olho seco por deficiência do filme lacrimal2,3,15,28,29.
Dentre os fatores sistêmicos que podem favorecer a DGM destacam-se deficiência androgênica, menopausa, envelhecimento, síndrome de Sjögren, pênfigo cicatricial, síndrome de Stevens-Johnson, lúpus eritematoso sistêmico, hipercolesterolemia, psoríase, atopia, rosácea, hipertensão arterial sistêmica (HAS), hiperplasia benigna da próstata (HPB), transplante alogênico ou autólogo de células-tronco, síndrome da displasia ectodérmica, doença de Parkinson, síndrome do ovário policístico, necrólise epidérmica tóxica e síndrome de Turner1,3-13,22,24,25,30.
Medicamentos associados com a patogênese da DGM compreendem antiandrogênios, medicamentos para HPB, terapia hormonal (estrógenos e progesterona), anti-histamínicos, antidepressivos e retinoides sistêmicos (isotretinoína)31.
Fatores ambientais como geografia, temperatura, umidade e tarefa visual podem desempenhar um papel na DGM e/ou seu impacto de piora dos sintomas nos pacientes por agravamento da disfunção do filme lacrimal. O aumento da frequência de DGM em populações asiáticas pode estar relacionado a diferenças geoclimáticas (temperatura, umidade e qualidade do ar)3,27. Usuários de computador (diminuição da frequência de piscar) geralmente se queixam de fadiga ocular, queimação, irritação e vermelhidão.
Clínica e Diagnóstico
Clinicamente, a DGM pode ser categorizada em quatro subtipos: 1- DGM primária, que se subdivide em assintomático e sintomático e esta, por sua vez, subdivide-se em não cicatricial e cicatricial; 2- DGM associado a danos na superfície ocular; 3- Olho seco evaporativo relacionado a DGM e, 4- DGM associada a outros distúrbios oculares.
O International Workshop on Meibomian Gland Dysfunction Report sugere classificação de gravidade em 5 níveis descritos abaixo com base em avaliação de sintomas (frequência e gravidade, graduação do Ocular Surface Disease Index - OSDI) e função da glândula meibomiana (morfologia da pálpebra, atrofia da glândula, expressibilidade do meibum e qualidade da secreção)1,32,33.
Nível 1 - Subclínico: ausência de sintomas de desconforto ocular, coceira ou fotofobia, associados a sinais clínicos de DGM com base na expressão da glândula (secreções minimamente alteradas) e sem coloração da superfície ocular;
Nível 2 - Sintomático mínimo: sintomas de desconforto ocular, coceira ou fotofobia, associados a sinais clínicos de DGM com base na expressão da glândula (secreções minimamente alteradas) e sem coloração da superfície ocular;
Nível 3 - Sintomático leve: sintomas de desconforto ocular, coceira ou fotofobia, associados a sinais clínicos de DGM mínimos a leves (secreções ligeiramente alteradas) e sem coloração da superfície (Figura 1);

Nível 4 - Sintomático moderado: sintomas moderados de desconforto ocular, coceira ou fotofobia com limitação de atividades, associados a sinais clínicos moderados de DGM (obstrução, vascularidade, secreções moderadamente alteradas e coloração da córnea periférica e conjuntival leve a moderada, frequentemente inferior) (Figura 2);
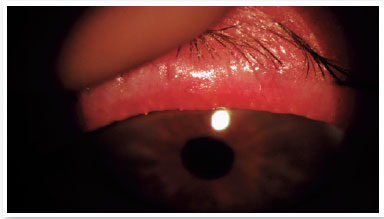
Nível 5 - Sintomático grave: sintomas frequentes e intensos de desconforto ocular, coceira ou fotofobia com limitação de atividades, associados a sinais clínicos graves de DGM (secreções gravemente alteradas e aumento da intensidade da sua coloração), inflamação conjuntival e corneana, incluindo região central (Figura 3).
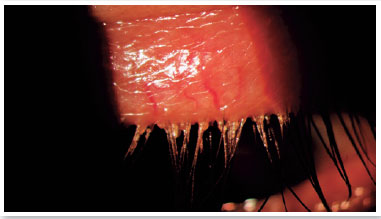
A DGM manifesta-se muitas vezes de forma assintomática e, outras vezes, repleta de sintomatologia como coceira, queimação nos olhos, sensação de areia nos olhos, pálpebras inchadas, secura ocular, irritação ocular, lacrimejamento, crosta nos cílios (principalmente de manhã), pálpebras coladas, vermelhidão ocular, fotofobia leve, turvação visual, queimação, hiperemia das margens palpebrais e formação de crostas, entre outros17,34-36. Os sintomas podem variar em frequência e gravidade, podendo sofrer influência de fatores como clima, umidade ou nível de atividade (uso de computador). A compreensão e a quantificação desses aspectos subjetivos da DGM assim como o impacto percebido da doença na vida do indivíduo, são necessárias para que técnicas válidas possam ser utilizadas para avaliação da DGM3.
O exame oftalmológico de lâmpada de fenda visa o reconhecimento das alterações morfológicas das margens palpebrais como alterações de vascularização, telangiectasias, úlceras, queratinização, escamas e crostas, também chamadas de colaretes nos cílios. A margem palpebral pode estar espessada e apresentar junção cutaneomucosa (linha de Marx) que nessa doença pode estar interiorizada. Os orifícios de drenagem das glândulas de Meibomius devem ser observados se estão bem delimitados e rodeados por epitélio regular. Orifícios recobertos de gordura, elevados e dilatados indicam inflamação crônica. Orifícios não visíveis decorrem de glândulas não funcionantes, com ausência de secreção, contendo ceratina e células epiteliais descamadas sobre o local de drenagem17,36. Pode-se também associar ao quadro clínico, hordéolos, calázios, ausência de cílios (madarose) ou mau posicionamento dos cílios (triquíase e distiquíase)3.
No exame oftalmológico da córnea, conjuntiva e filme lacrimal, a conjuntiva tarsal pode manifestar hiperemia, inflamação, reação papilar e cicatrização. A conjuntiva bulbar pode apresentar hiperemia e flictênulas. Pode-se evidenciar na córnea e conjuntiva quadros de ceratopatia ponteada superficial, flictenulose e infiltrados marginais em áreas que correspondem a pontos de toque entre córnea e pálpebra18.
Para pacientes com sintomas de superfície ocular ou sinais morfológicos de DGM na pálpebra deve ser avaliada a funcionalidade das glândulas meibomianas por meio de pressão digital no terço central (± nasal) das pálpebras inferior/superior, para determinar a extensão e a gravidade da DGM (facilidade de expulsão e qualidade da secreção).
A atrofia parcial ou total da glândula meibomiana pode ser quantificada por meio de meiboscopia, meibografia e microscopia confocal.
O paciente deve ser avaliado para verificar evidências de lesão da superfície ocular e olho seco por meio de testes específicos, incluindo medida da osmolaridade lacrimal, teste de secreção lacrimal (fluorofotometria ou taxa de depuração de fluoresceína), medida do volume das lágrimas no olho (fluorofotometria e meniscometria), teste de estabilidade (TBUT ou interferometria) e medição da evaporação da lágrima (evaporimetria). Testes de danos na superfície ocular, como coloração da córnea e conjuntiva, também estão incluídos na série de testes. A avaliação de mediadores inflamatórios e a presença de marcadores de células inflamatórias e outras análises de espectrometria de massa proteômica e lipidômica, fornecem informações sobre o estado inflamatório geral da superfície ocular. Medidas específicas de produção de lágrimas para o diagnóstico de olho seco com deficiência aquosa, como o teste de Schirmer, também são recomendadas.
Tratamento
O International Workshop on Meibomian Gland Dysfunction Report padronizou o tratamento de acordo com o estágio da doença conforme achados clínicos:
Nível 1: orientação ao paciente sobre dieta, medicações e ambientes de trabalho/casa que proporcionam piora do ressecamento ocular, associado higiene palpebral e compressas mornas;
Nível 2: orientações do nível 1, associados a melhoria da umidificação do ambiente, aumento da ingestão dietética de ácidos graxos ômega-3, higiene palpebral com compressas mornas (mínimo de 4 minutos, uma ou duas vezes ao dia), lubrificantes artificiais (uso frequente de preferência sem conservantes), lubrificante emoliente tópico ou spray lipossomal e azitromicina tópica ou tetraciclina via oral (VO).
Níveis 3 e 4: todos os itens do nível 2 associados a tetraciclina VO, pomada lubrificante emoliente ao dormir e terapia anti-inflamatória para olho seco25.
Todos os pacientes diagnosticados, independente do estágio, beneficiam-se da higiene sistemática e contínua da margem palpebral. O aumento da temperatura local por meio de compressas mornas e massagem facilita o fluxo da secreção, desobstrução dos ductos e a circulação vascular ao redor das glândulas1,14,17,26,36. Fontes alternativas de calor para terapia de compressa quente incluem dispositivos de aquecimento ocular, irradiação infravermelha ou ar úmido ou máscaras de aquecimento ocular1.
Em casos de processos infecciosos bacterianos crônicos locais, pomadas antibióticas oftalmológicas tópicas podem ser prescritas de uma a quatro vezes por dia, dependendo da gravidade do processo por uma a quatro semanas.
Pode-se associar também, o uso tópico de pomada oftalmológica de corticosteroide na margem palpebral, cujo objetivo é suprimir a inflamação aguda e processos alérgicos associados. Seu uso deve ser por curto período devido ao risco de aumento de pressão intraocular e indução de catarata. Colírios de ciclosporina e tacrolimus têm sido utilizados na prática clínica como alternativa anti-inflamatória aos corticosteroides.
Antibióticos orais de tetraciclina, doxaciclina ou de azitromicina modificam a microbiota local e melhoram a secreção lipídica, reduzindo diretamente a produção de lipases bacterianas de Staphylococcus aureus, Staphylococcus epidermidis e Propionibacterium acnes, diminuindo a concentração de ácidos graxos livres e seus efeitos deletérios na camada lipídica do filme lacrimal1,14,17,26.
Lubrificantes oculares representam apoio à disfunção lacrimal, uma vez que a DGM frequentemente associa-se à disfunção do filme lacrimal.
CONSIDERAÇÕES FINAIS
Na prática clínica nota-se prejuízo oftalmológico da DGM, assim como seu impacto na qualidade de vida do indivíduo e, pela sua alta prevalência, impacto socioeconômico.
Por se tratar de uma enfermidade crônica, o acompanhamento deverá ser periódico, com abordagem multidisciplinar, considerando outras doenças associadas, medicações utilizadas pelo paciente e até mesmo fatores ambientais.
Portanto, o conhecimento sobre DGM gerado a partir de estudos científicos é necessário não somente aos oftalmologistas, mas também a toda classe médica, salientando a importância do indivíduo ser considerado como um todo.
REFERÊNCIAS
1. MGD redefined: International Workshop on Meibomian gland dysfunction report. Boston: The Tear Film & Ocular Surface Society (TFOS); 2011. Disponível em: www.tearfilm.org/mgdworkshop/index.html.
2. Knop E, Knop N, Millar T, Obata H, Sullivan DA. The international workshop on meibomian gland dysfunction: report of the subcommittee on anatomy, physiology, and pathophysiology of the meibomian gland. Invest Ophthalmol Vis Sci. 2011;52(4):1938-78.
3. Schaumberg DA, Nichols JJ, Papas EB, Tong L, Uchino M, Nichols KK. The international workshop on meibomian gland dysfunction: report of the subcommittee on the epidemiology of, and associated risk factors for, MGD. Invest Ophthalmol Vis Sci. 2011;52(4):1994-2005.
4. Chen A, Chen HT, Chen HC, Chen YT, Hwang YH, Sun CC, et al. Asymptomatic meibomian gland dysfunction and cardiovascular disease risk factors in a middle-aged population in Taiwan: a cross-sectional analysis. Sci Rep. 2017;7(1):4935.
5. Siak JJ, Tong L, Wong WL, Cajucom-Uy H, Rosman M, Saw SM, et al. Prevalence and risk factors of meibomian gland dysfunction: the Singapore Malay eye study. Cornea. 2012;31(11):1223-8.
6. Tulsyan N, Gupta N, Agrawal N. Risk factors associated with meibomian gland dysfunction: a hospital based study. Nepal J Ophthalmol. 2021;13(25):59-64.
7. Yamaguchi M, Nishijima T, Shimazaki J, Takamura E, Yokoi N, Watanabe H, et al. Real-world assessment of diquafosol in dry eye patients with risk factors such as contact lens, meibomian gland dysfunction, and conjunctivochalasis: subgroup analysis from a prospective observational study. Clin Ophthalmol. 2015 Dec 1;9:2251-6.
8. Braich PS, Howard MK, Singh JS. Dyslipidemia and its association with meibomian gland dysfunction. IntOphthalmol. 2016;36(4):469-76.
9. Dao AH, Spindle JD, Harp BA, Jacob A, Chuang AZ, Yee RW. Association of dyslipidemia in moderate to severe meibomian gland dysfunction. Am J Ophthalmol. 2010;150(3):371-5.e1.
10. Kuriakose RK, Braich PS. Dyslipidemia and its association with meibomian gland dysfunction: a systematic review. Int Ophthalmol. 2018;38(4):1809-16.
11. Guliani BP, Bhalla A, Naik MP. Association of the severity of meibomian gland dysfunction with dyslipidemia in Indian population. Indian J Ophthalmol. 2018;66(10):1411-6.
12. Mussi N, Haque W, Robertson DM. The association between risk factors for metabolic syndrome and meibomian gland disease in a dry eye cohort. Clin Ophthalmol. 2021 Sep 11;15:3821-32.
13. Lin X, Wu Y, Chen Y, Zhao Y, Xiang L, Dai Q, et al. Characterization of meibomian gland atrophy and the potential risk factors for middle aged to elderly patients with cataracts. Transl Vis Sci Technol. 2020;9(7):48.
14. Lemp MA, Nichols KK. Blepharitis in the United States 2009: a survey-based perspective on prevalence and treatment. Ocul Surf. 2009;7(2 Suppl):S1-14.
15. Ong BL. Relation between contact lens wear and Meibomian gland dysfunction. Optom Vis Sci. 1996;73(3):208-10.
16. Adam Netto AA, Rolim AP, Muller TP. Prevalência de doenças palpebrais no serviço emergencial de oftalmologia do hospital universitário da Universidade Federal de Santa Catarina. ACM arq catarin med. 2006;35(4):64-9.
17. Santo RM. Blefarite e blefaroconjuntivitivites. In: Alves MR, Nakashima Y, Tanaka T, editores. Clínica oftalmológica: condutas práticas em oftalmologia. Rio de Janeiro: Guanabara Koogan; 2013. p. 436-7.
18. Hida RY, Santo RM. Blefarites e disfunção das glândulas de Meibomius. In: Alves MR, Santo RM, Sousa SJF, Costa DC, editores. Essencial em blefaroconjuntivites. São Paulo: Omnifarma; 2012. p. 13-24.
19. Management and therapy of dry eye disease: report of the Management and Therapy Subcommittee of the International Dry Eye WorkShop. Ocul Surf. 2007;5(2):163-78.
20. Motta AA, Aun MV, Kalil J, Giavina-Bianchi P. Dermatite de contato. Rev Bras Alerg Imunopatol. 2011;34(3):73-82.
21. Leung DM, Eichenfield LF, Boguniewicz M. Atopic dermatitis (atopic eczema). In: Goldsmith LA, Katz SI, Gilchrest BA, Paller AS, Leffell DJ, Wolff K, editores. Fitzpatrick’s dermatology in general medicine. New York: McGraw Hill; 2008. p.146-58.
22. Hanifin JM, Rajka G. Diagnostic features of atopic dermatites. Acta Dermatovener (Stockholm). 1980;92(Suppl):44-7.
23. Ferolla C. Dermatite seborreica da face.Rev Bras Med. 2010;67(supl 9):11-5.
24. Al Arfaj K, Al Zamil W. Spontaneous corneal perforation in ocular rosacea. Middle East Afr J Ophthalmol. 2010;17(2):186-8.
25. Vieira AC, Höfling-Lima AL, Mannis MJ. Ocular rosacea: a review. ArqBras Oftalmol. 2012;75(5):363-9.
26. Adán CBD, Araujo MERX, Hofling-Lima AL, Nishiwaki-Dantas MC, Alves MR. Doenças externas oculares e córnea. Série Brasileira de Oftalmologia, CBO. 3ª ed. Rio de Janeiro: Cultura Médica, Gen, Guanabara Koogan; 2013.
27. Asbell PA, Stapleton FJ, Wickström K, Akpek EK, Aragona P, Dana R, et al. The international workshop on meibomian gland dysfunction: report of the clinical trials subcommittee. Invest Ophthalmol Vis Sci. 2011;52(4):2065-85.
28. Dias MR, Guaresch BLV, Borges CR, Biazim DF, Casagrande D, Luz RA. Blefarite: epidemiologia, etiologia, apresentações clínicas, tratamento e evolução de nossos pacientes. Rev Bras Oftalmol. 2019;78(5):300-3.
29. Holzchuh FG, Hida RY, Moscovici BK, Villa Albers MB, Santo RM, Kara-José N, et al. Clinical treatment of ocular Demodex folliculorum by systemic ivermectin. Am J Ophthalmol. 2011; 151(6):1030-4.e1.
30. Sullivan DA, Sullivan BD, Evans JE, Schirra F, Yamagami H, Liu M, et al. Androgen deficiency, Meibomian gland dysfunction, and evaporative dry eye. Ann N Y Acad Sci. 2002 Jun;966:211-22.
31. Baser G, Yildiz N, Calan M. Evaluation of meibomian gland dysfunction in polycystic ovary syndrome and obesity. Curr Eye Res. 2017;42(5):661-5.
32. Methodologies to diagnose and monitor dry eye disease: report of the Diagnostic Methodology Subcommittee of the International Dry Eye WorkShop (2007). Ocul Surf. 2007;5(2):108-52.
33. Design and conduct of clinical trials: report of the Clinical Trials Subcommittee of the International Dry Eye WorkShop (2007). Ocul Surf. 2007;5(2):153-62.
34. Acharya N, Pineda R 2nd, Uy HS, Foster CS. Discoid lupus erythematosus masquerading as chronic blepharoconjunctivitis. Ophthalmology. 2005;112(5):e19-23.
35. Xavier ME, Souza MB, Hofling-Lima AL, Santo RM, Alves MR. Blepharitis, conjunctivitis and trachoma. In: Boyd BF, editor. Modern ophthalmology: the highlights the account of a master witnessing a 60 epoch of Evolution and progress (1950-2010).Panama: Jaypee-Highlights Medical Publishers; 2010. p. 221-240.
36. Geerling G, Tauber J, Baudouin C, Goto E, Matsumoto Y, O’Brien T, et al. The international workshop on meibomian gland dysfunction: report of the subcommittee on management and treatment of meibomian gland dysfunction. Invest Ophthalmol Vis Sci. 2011;52(4):2050-64.
INFORMAÇÃO DOS AUTORES


Financiamento: Declaram não haver.
Conflitos de Interesse: Declaram não haver.
Recebido em:
15 de Dezembro de 2022.
Aceito em:
13 de Março de 2023.