Thaís Mota Gomes; Gustavo David Ludwig; Eric Pinheiro de Andrade
DOI: 10.17545/eOftalmo/2022.0009
RESUMO
A síndrome de Horner, um distúrbio associado a lesão ipsilateral da via simpática, é uma complicação rara da canulação na veia jugular interna (VJI). Dependendo da intensidade da lesão e da localização, o dano pode ser irreversível, mesmo em crianças pequenas.
Palavras-chave: Síndrome de Horner; Crianças; Nervo simpático; Lesão; Veia jugular.
ABSTRACT
Horner’s syndrome, a disorder associated with ipsilateral damage to the sympathetic pathway, is a rare complication of cannulation into the internal jugular vein. Depending on the intensity of the injury and location, the damage may be irreversible, even in young children.
Keywords: Horner’s syndrome; Children, Sympathetic nerve; Injury; Jugular vein.
INTRODUÇÃO
A síndrome de Horner é classicamente descrita como uma tríade de miose, blefaroptose (ou ptose palpebral) e anidrose, mas é também caracterizada por enoftalmia, pseudoenoftalmia (devido à ptose palpebral superior e elevação da pálpebra inferior), hiperemia da bochecha e heterocromia da íris no lado ipsilateral da lesão ao nervo simpático ao longo do seu trajeto do hipotálamo ao olho1.
Em pediatria, a síndrome de Horner é classificada como congênita ou adquirida. O diagnóstico é importante para o diagnóstico etiológico subsequente, fornecendo medidas terapêuticas e acompanhamento1,2.
Avaliação clínica e neuroimagem (TC/RM e angiografia) são essenciais para diferenciar as causas inflamatórias, neoplásicas ou traumáticas3.
Relatamos aqui um caso raro de síndrome de Horner pediátrica e completa secundária à canulação da veia jugular interna onde não houve regressão das sequelas mesmo após um ano.
RELATO DO CASO
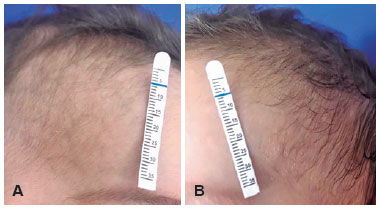
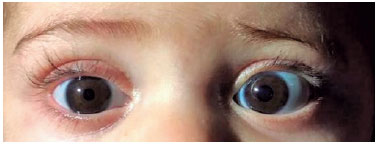
Um menino de sete meses, gêmeo prematuro, foi examinado em nossa instituição dois meses após a admissão dele em outro hospital por bronquiolite. Segundo a mãe, a criança necessitou de acesso venoso central devido à impossibilidade de acesso periférico para a administração de medicamentos. Inicialmente, cateteres centrais de inserção periférica (PICC) foram utilizados sem sucesso, então os cateteres venosos de inserção central (CVC) foram os escolhidos. Um dia após a inserção dos cateteres, a mãe do paciente notou a ptose palpebral direita do filho. Um oftalmologista foi consultado e a criança foi encaminhada ao departamento de neuroftalmologia. Foram observados no exame: ptose palpebral superior, anidrose facial (Figura 1) e miose visível em ambiente escotópico [pupila esquerda (4mm) maior do que a da direita (2mm), Figura 2] ipsilateral ao local da punção. Anisocoria não foi mostrada em ambiente fotópico. Não foram encontradas alterações tanto no exame de oculomotricidade quanto na biomicroscopia. A avaliação clínica chegou ao diagnóstico de síndrome de Horner. Apesar da história do CVC sugerir um mecanismo traumático, a investigação com exames de imagem foi realizada. Dois meses após a colocação do CVC, os resultados de ressonância magnética (RNM) cerebral e cervical com sequências angiográficas, TC de tórax e ultrassom Doppler da VJID (Veia Jugular Interna Direita) foram normais. Não foram realizados testes farmacológicos oculares ou teste de catecolaminas na urina. Após as causas neoplásicas e inflamatórias serem excluídas, admitiu-se lesão traumática da via óculo-simpática. Concluímos tratar-se de um caso de Síndrome de Horner completa induzida por trauma mecânico durante a canulação da VJI com lesão de um neurônio de segunda ordem do suprimento nervoso simpático. Manejo conservador com monitoramento periódico foi realizado. Um ano após o diagnóstico, não houve evidência de deficiência visual ou prejuízo no desenvolvimento psicomotor do paciente quando comparado a outras crianças da mesma faixa etária e com seu gêmeo idêntico que não tem síndrome de Horner.
DISCUSSÃO
A síndrome de Horner é classicamente conhecida como blefaroptose unilateral e miose com graus variáveis de anidrose facial. Enoftalmia é uma característica que pode também estar presente. A síndrome resulta da interrupção ipsilateral da inervação simpática4,5.
Nos mais jovens foi estimada a incidência de 1,42 por 100.000, sendo 40% congênitos, 42% adquiridos após procedimento cirúrgico no tórax, pescoço ou sistema nervoso central e 15% adquiridos por causas que incluíam neuroblastoma, tumores na medula espinhal, rabdomiossarcoma de células embrionárias, malformações vasculares, aneurisma intratorácico e trauma6.
No presente relato, demonstramos um caso de síndrome de Horner pediátrica induzida por cateter venoso central, causada por trauma direto. Casos semelhantes foram relatados, geralmente secundários a anormalidades anatômicas ou complicações decorrentes da técnica de punção.
Durante o PICC, punciona-se uma veia periférica e passa-se um dispositivo até atingir o terço distal da veia cava superior ou terço proximal da veia cava inferior. Esta técnica é vantajosa devido ao seu custo mais baixo, facilidade de cateterização e menor risco de infecção, mas não é indicada se um grande volume de líquido for necessário. Nesta situação, como no presente caso, uma grande veia central é acessada diretamente (CVC). A veia jugular interna direita é a escolhida em crianças devido ao menor risco de pneumotórax e compressão mais fácil em caso de hematomas. No entanto, neste caso, a lesão da via simpática pode ter ocorrido devido ao desconforto respiratório causado pela bronquiolite aguda, agitação psicomotora e dificuldade em sedar a criança durante a inserção. Além disso, o ultrassom não foi utilizado durante o procedimento. Embora o recurso não seja obrigatório, reduziria o risco de complicações.
O tronco simpático está intimamente relacionado com a bainha carotídea em sua parede posterior e 18% dos pacientes com menos de seis anos têm anatomia anômala da VJI, principalmente quando a VJI sobrepom-se à artéria carótida7. Para evitar complicações, a literatura destaca fatores que diminuem o risco de lesão do tronco simpático: experiência profissional, posicionamento do paciente, sedação e uso de ultrassom. A veia jugular interna direita (VJID) apresenta várias vantagens como local de canulação, possuindo uma anatomia previsível, mesmo em crianças. Embora a abordagem posterior seja tecnicamente mais difícil, uma taxa de sucesso de canulação de 98% foi relatada usando a abordagem posterior em bebês de um dia de nascidos a crianças de até 12 anos de idade8. Especialmente em casos pediátricos, a sedação é importante para diminuir a agitação psicomotora.
Os sintomas apresentados dependem da localização da via ocular simpática. No caso exposto, a presença de anidrose, ausência de dano psicomotor ou envolvimento de nervo craniano associado à topografia do trauma sugere envolvimento no neurônio de segunda ordem. O suprimento nervoso simpático para o olho se origina no hipotálamo posterolateral. Os neurônios de primeira ordem (central) descem para a sinapse, com neurônios de segunda ordem no centro cilioespinhal (de Budge) entre a raiz de C8 e a raiz de T1. Esses neurônios de segunda ordem (fibras pré-ganglionares) passam pelo ápice pulmonar, ascendem no pescoço na cadeia simpática cervical atrás da artéria carótida comum fora da bainha carotídea, ascendem através dos gânglios cervicais estrelados e médios e, então, ocorre a sinapse com neurônios de terceira ordem (pós-gangliônicos) no gânglio cervical superior, localizado no ângulo da mandíbula1,3.
Para confirmação diagnóstica, pode-se utilizar a localização da lesão na via oculossimpática e elucidação etiológica, avaliação clínica, exames farmacológicos e laboratoriais e neuroimagem. Especialmente em casos pediátricos, a exclusão de malignidade é o principal objetivo.
Neste caso, em que os sinais clínicos mostram síndrome de Horner completa iniciada após trauma ipsilateral por canulação de VJI, não foram realizados testes farmacológicos oculares (cocaína, apraclonidina ou hidroxianfetamina) ou teste de catecolaminas na urina. O estudo de neuroimagem foi realizado para excluir outras lesões e identificar complicações com a inserção de um cateter central que pudessem justificar a síndrome.
O protocolo mais recente para investigação por imagem da síndrome de Horner inclui a imagem de ressonância magnética de cabeça, pescoço e tórax superior, angiografia dos vasos do pescoço em suspeita de envolvimento pós-gangliônico ou sem causa provável. A TC é indicada principalmente se houver suspeita de lesão traumática da base do crânio3,5.
George et al. recomendam apenas imagens de cabeça, pescoço e tórax para pacientes com mais de um ano de idade no momento da apresentação2. Para pacientes com menos de um ano de idade, eles recomendam catecolaminas urinárias e exame para massas cervicais ou abdominais, porém Jeffery et al. mencionam que a investigação abdominal deve ser feita em casos sem lesão conhecida (ou seja, trauma cirúrgico ou decorrente de parto)9.
Corroborando com o estudo de neuroimagem realizado no presente relato, Barrea et al. afirmam que história de trauma ou cirurgia pode reduzir a necessidade de extensa avaliação sistêmica5. No entanto, é importante certificar-se de que a avaliação minuciosa deve ser feita em pacientes cujo exame clínico não fornece informações suficientes para localizar a lesão com certeza ou quando não há uma causa provável devido à associação frequente de doença subjacente grave.
Três meses após a canulação da VJI, a observação materna e o exame clínico mostraram que o cabelo do lado direito era mais liso que o contralateral. Durante a apresentação ou avaliação, não foram relatados enoftalmos, pseudo-enoftalmia, hiperemia da bochecha ou heterocromia da íris. Aos 12 meses, a criança mantém ptose direita, miose e anidrose sem resolução, mas o cabelo é crespo bilateralmente. Outros estudos sem alterações de neuroimagem com provável dano direto da agulha no tronco simpático tiveram resultados diferentes. Uma criança de seis anos teve regressão da ptose e miose 18 dias após o desenvolvimento da síndrome de Horner e um menino de cinco anos teve remissão completa dos sintomas após cinco meses3,5. Em uma criança mais nova com sete meses de idade, no acompanhamento de 12 meses, ainda era possível ser notada uma leve ptose do olho direito e a anisocoria foi completamente resolvida10.
REFERÊNCIAS
1. Cahill JA, Ross J. Eye on children: acute work-up for pediatric Horner’s syndrome. case presentation and review of the literature. J Emerg Med. 2015;48(1):58-62.
2. George NDL, Gonzalez G, Hoyt CS. Does Horner’s syndrome in infancy require investigation? Br J Ophthalmol.1998;82(1):51-4.
3. Kadom N, Rosman NP, Jubouri S, Trofimova A, Egloff AM, Zein WM. Neuroimaging experience in pediatric Horner syndrome. Pediatr Radiol. 2015;45(10):1535-43.
4. Barrea C, Vigouroux T, Karam J, Milet A, Vaessen S, Misson JP. Horner syndrome in children: a clinical condition with serious underlying disease. Neuropediatrics. 2016;47(4):268-72.
5. Links DJR, Crowe PJ. Horner’s syndrome after placement of a peripherally inserted central catheter. JPEN J Parenter Enteral Nutr. 2006;30(5):451-2.
6. Smith SJ, Diehl N, Leavitt JA, Mohney BG. Incidence of pediatric Horner syndrome and the risk of neuroblastoma: a populationbased study. Arch Ophthalmol. 2010;128(3):324-9.
7. Alderson PJ, Burrows FA, Stemp LI, Holtby HM. Use of ultrasound to evaluate internal jugular vein anatomy and to facilitate central venous cannulation in paediatric patients. Br J Anaesth. 1993;70(2):145-8.
8. Chatrath RR, Stock JG, Jones OD. Internal jugular catheterisation in small children. The use of a posterior approach. Anaesthesia. 1983;38(4):380-3.
9. Jeffery AR, Ellis FJ, Repka MX, Buncic JR. Pediatric Horner syndrome. J AAPOS. 1998;2(3):159-67.
10. Knyazer B, Smolar J, Lazar I, Rosenberg E, Tsumi E, Lifshitz T, et al. Iatrogenic Horner Syndrome: Etiology, Diagnosis and Outcomes. Isr Med Assoc J. 2017;19(1):34-38.
INFORMAÇÃO DOS AUTORES

Financiamento: Declaram não haver
Conflitos de Interesse: Declaram não haver
Recebido em:
5 de Julho de 2022.
Aceito em:
2 de Agosto de 2022.