Carlos Augusto Moreira Neto1; Carlos Augusto Moreira Júnior2
DOI: 10.17545/e-oftalmo.cbo/2015.32
RESUMO
Este estudo relata o caso de um paciente adulto com depósitos tipo drusen em ambos os olhos, evoluindo rapidamente para atrofia macular extensa. A história clínica foi documentada na íntegra por oito anos com imagens de fundo de olho e, embora semelhante à degeneração macular atrófica relacionada à idade, a atrofia macular pode ser distinguida por características marcantes como depósitos extensos do tipo drusen no polo posterior de ambos os olhos, atrofia macular vertical e deteriorização da acuidade visual em pacientes com idade inferior a 50 anos.
Palavras-chave: Programas de Rastreamento. Técnicas de Diagnóstico Oftalmológico. Crianças. Refração Ocular. Ambliopia.
ABSTRACT
Here, we describe an adult male with extensive drusen-like deposits in both eyes, rapidly progressing to extensive {2.1 [EN] Verify English word/phrase choice} macular atrophy. A fully documented eight-year clinical history, with fundus images, has been reported, and although macular atrophy may resemble atrophic age-related macular degeneration, it can be distinguished by some striking features, including extensive drusen-like deposits in the posterior pole of both eyes, vertical macular atrophy, and rapid deterioration of visual acuity in patients under 50 years of age.
Keywords: Vision-screening programs. Ophthalmological diagnostic techniques. Children. Ocular refraction.
INTRODUÇÃO
A atrofia macular é uma doença que acomete a retina, levando à deficiência visual grave. As causas têm origens diferentes como inflamação, intoxicação, fatores hereditários, e, predominantemente, degeneração macular relacionada à idade (DMRI). O curso da atrofia macular em DMA tem sido bem documentado 1,2,3,4. Após o surgimento de depósitos tipo drusen, pequenas áreas de atrofia ocorrem na região perifoveal. Essas áreas tendem a ser confluentes ao longo dos anos e acompanham o desaparecimento ou achatamento de drusas moles 3,4,5. Normalmente, a atrofia macular não se estende além da área perifoveal; no entanto, alguns pacientes podem desenvolvê-la em estágios tardios da doença, tornando-se legalmente cegos por volta de 70 anos de idade ou mais.
Este é o relato de um homem de 50 anos de idade com atrofia macular com depósitos tipo drusen no pólo posterior de ambos os olhos, acompanhado por 8 anos. Embora seja semelhante à DMA atrófica, a atrofia macular tem uma aparência clínica distinta e foi considerada uma nova entidade clínica por Hamel et al.6 em 2009. As características marcantes incluem o surgimento precoce de atrofia macular bilateral simétrica que ocorre geralmente em pacientes com idade inferior a 50 anos de idade, com um rápido envolvimento da fóvea e de todo o pólo posterior até as arcadas vasculares temporais6.
RELATO DE CASO:
Em 2007, um homem branco de 43 anos de idade procurou atendimento oftalmológico por estar com a visão deteriorada. A acuidade visual (AV) foi de 20/20 OU com correção de -7,00 D. A pressão intra-ocular foi de 13 mmHg, e a imagem de fundo de olho revelou depósitos tipo drusen no pólo posterior de ambos os olhos. Angiografias fluoresceínicas de fundo de olho foram realizadas, revelando depósitos tipo drusen em ambos os olhos (Figura 1). Antioxidantes orais e vitaminas foram prescritos para o paciente conforme formulação do AREDS, Age-Related Eye Disease Sturdy (Estudo de Doenças Oculares Relacionadas à Idade).
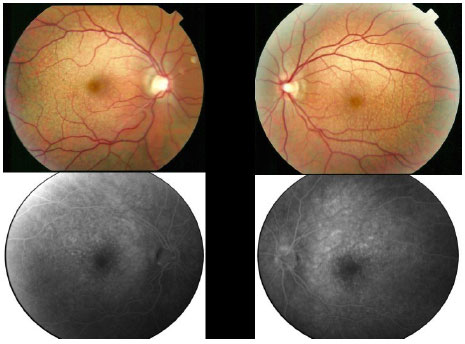
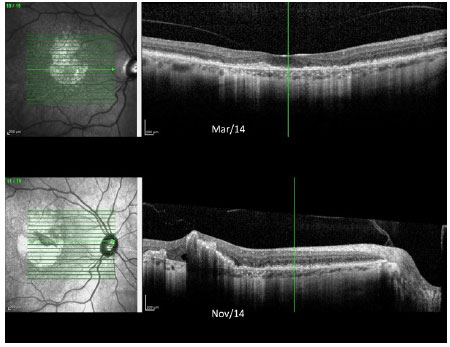
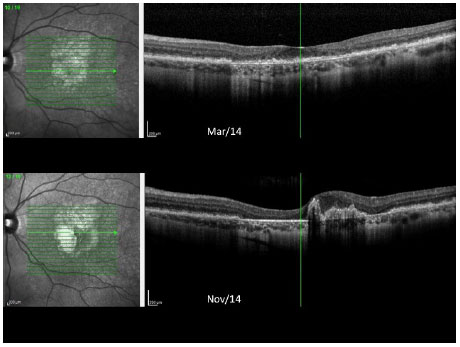
Em 2012, o paciente foi reexaminado em outra clínica, apresentando a mesma visão comprometida e as mesmas queixas. Imagens coloridas de fundo de olho foram feitas durante essa visita e posteriormente enviadas para estudo. No início de 2014, o paciente sofreu uma grande perda da visão e retornou para fazer um novo exame que revelou AV de 20/200 OD e 20/60 OS. Uma área de atrofia foi observada nas regiões foveal e perifoveal, juntamente com áreas de degeneração simulando pedras de calçamento, distantes da região periférica de ambos os olhos. Retinografia colorida, autofluorescência e angiofluoresceinografia foram realizadas, revelando uma área definida de atrofia macular em ambos os olhos com um diâmetro vertical maior (Figura 2). Electroretinografia multifocal (ERG) mostrou uma diminuição acentuada da função dos cones de ambos os olhos (Figura 3). A ERG do campo cheio apresentou-se normal. A tomografia de coerência ótica (OCT) revelou afinamento da mácula na área atrófica com espessura foveal central medindo menos de 200 µ.
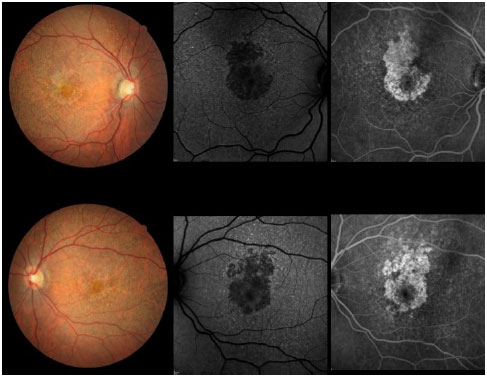
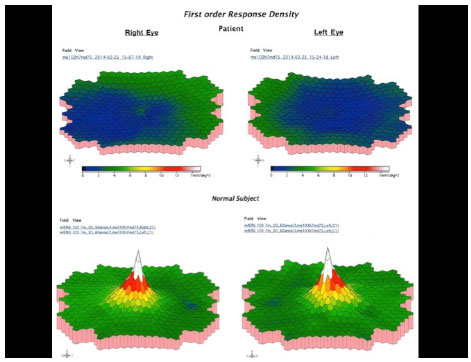
A essa altura, a queixa principal do paciente estava relacionada à sua visão à distância. Ele alegou que ainda podia 1er sem óculos em função do erro miópico alto, e precisava de uma luz brilhante para realizar tarefas de curta distância. O paciente não tinha problemas em matéria de adaptação à luz e não se queixou de fotofobia. No entanto, a visão de cores foi severamente afetada. Um escotoma central estava presente nos campos visuais de ambos os olhos.
Nos meses seguintes, a visão do paciente deteriorou-se rapidamente, e em outubro de 2014, a AV foi de 20/200 OU. A leitura só foi possível com ajuda para baixa visão.
Imagens de fundo de olho de ambos os olhos feitas durante o acompanhamento são mostradas na Figura 4. As imagens de OCT de ambos os olhos obtidas no ano passado são mostradas nas Figuras 5 e 6.
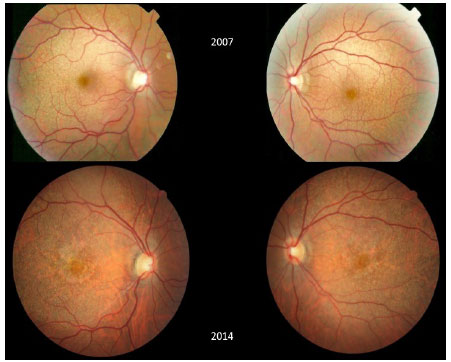
DISCUSSÃO:
Com o avanço da tecnologia e com o aumento do nosso conhecimento sobre DMA, seremos capazes de identificar diferentes formas de doenças maculares que ocorrem na idade adulta. Recentemente, Hamel et al.6 descreveram uma forma de atrofia macular que ocorre mais cedo do que a DMA. Embora a atrofia macular seja semelhante à DMA, os autores a descreveram como uma nova entidade clínica com características diferentes da DMA. As principais características incluem atrofia macular extensa com um diâmetro vertical maior, ocorrendo por volta de 50 anos, juntamente com depósitos pseudodrusen afetando todo o pólo posterior e degeneração simulando pedras de calçamento na periferia da retina.
Hamet et al. descreveram 18 pacientes com 50 anos de idade aproximadamente e com queixas de perda visual rápida, cegueira noturna e escotoma central. O surgimento rápido da perda visual e da atrofia macular foram características marcantes. Provavelmente, muitos destes pacientes foram previamente diagnosticados com um tipo precoce de DMA. O trabalho de Hamel et al.6 levou-nos a considerar tal doença retiniana como uma nova entidade clínica e as suas características específicas e curso clínico devem ser identificados para que os pacientes sejam adequadamente tratados.
Portanto, os pacientes adultos com depósitos tipo drusen no pólo posterior de ambos os olhos podem ter um curso clínico diferente daqueles com depósitos regulares tipo drusen na área macular. De acordo com as nossas observações, esses pacientes rapidamente progrediram para perda visual central, tornando-se legalmente cegos por volta de 50 anos de idade. Todas as outras características previamente descritas por Hamel et al.6 foram observadas no caso presente, incluindo atrofia macular extensa em ambos os olhos com um diâmetro vertical maior, escotoma central, depósitos tipo drusen no pólo posterior, déficit de visão colorida, degeneração simulando pedras de calçamento na periferia da retina, ERG focal mostrando uma grave diminuição da função cone e rápida deterioração da AV central.
Embora atualmente nenhum tratamento esteja disponível para esta doença, é importante identificar tal entidade clínica para que não seja confundida com DMA em pacientes mais jovens.
REFERENCIAS
1 klein ML, Ferris FL, Armstrong J. et al. AREDS Research Group. Retinal precursors and the development of geographic atrophy in age-related macular degenerations. Ophthalmology 2008;115:1026-1031.
2 Arnold JJ, Sarks SH, Killingsworth MC, Sarks JP. Reticular pseudodrusen. A risk factor in age-related maculopathy. Retina 1995;15:183-191.
3 Schatz H, McDonald HR. Atrophie macular degeneration. Rate of spread of geographic atrophy and visual loss. Ophthalmology 1989; 96:1541-1551.
4 Sunness JS, Gonzalez-Baron J, Applegate CA, et al. Enlargement of atrophy and visual acuity loss in the geographic atrophy form of age-related macular degeneration. Ophthalmology 1999;106:1768-1779.
5 Sunness JSA, Margalit E, Srikumaran D, et al. The long-term natural history of geographic atrophy from age-related macular degeneration: enlargement of atrophy and implications for interventional clinical trials. Ophthalmology 2007;114:271-277.
6 Hamel CP, Meunier I, Arndt C, et al. Extensive macular atrophy with pseudodrusen-like appearance: a new clinical entity. Am J Ophthalmol. 2009;147(4):609-20.

Comentário: Espectro da neuromielite óptica
Dr. Sergio Gianotti Pimentel
Chefe do Setor de Retina, Departamento de Oftalmologia, USP. sergiopimentel19@amail.com
Neste artigo, os autores apresentam um caso interessante de atrofia macular progressiva bilateral simétrica associada com extensos depósitos tipo drusen em um homem de meia-idade, compatível com o diagnóstico de atrofia macular extensa com aparência pseudodrusen (EMAP), recentemente relatada por Hamel et al.1
Em 2009, Hamel et al.1 relataram a primeira série de 18 casos EMAP, representando uma nova entidade clínica. Inicialmente, os pacientes apresentavam queixas de adaptação ao escuro, escotoma central e diminuição da visão de perto; depois, diminuição da visão distante seguida de perda de visão central bilateral. Os pacientes tinham sido previamente diagnosticados com distrofia macular incaracterístico, antes de 50 anos de idade, sem histórico familiar. A idade média do início da doença foi de 47 anos (variação, 41 -54 anos), 11/18 eram mulheres e miopia estava presente em 14/18 pacientes. A acuidade visual (AV) média inicial foi de 20/100 (percepção de luz de 20/20) e AV final foi reduzido a 20/200 em todos os olhos com exceção de um. Exames para aquisição de imagens do segmento anterior apresentaram-se normais. Outra série de casos EMAP foram posteriormente relatada por Querques et al2 e Kamami-Levy et al.3
Em resumo, EMAP foi diagnosticada pelas seguintes características:1,2,3 1. atrofia macular bilateral e simétrica com um diâmetro vertical maior; 2. rápido envolvimento do pólo posterior e da fóvea; 3. início precoce (idade <55 anos); 4. numerosos depósitos tipo pseudodrusen no pólo posterior e no equador; 5. degeneração simulando calçamento de pedra, predominantemente na retina periférica quadrante inferior ou temporal.
Os depósitos tipo pseudodrusen foram descritos como pontos "numerosos, amarelados, mal contrastados e planos localizados no pólo posterior e se parecem com drusas".6 A tomografia de coerência óptica demonstrou não haver espessamento nodular do complexo membrana de Bruch - epitélio pigmentar. Estes pontos eram hipofluorescentes em imagens autofluoresceínica e não eram visíveis em angiografia fluoresceínica de fundo de olho.1 Kamami-Levy et al3 constataram que a neovascularização de coróide pode estar presente em quase 10% dos olhos EMAP (4 de 38 olhos).3
O principal diagnóstico diferencial é a degeneração macular avançada relacionada à idade (DMA) com atrofia geográfica (AG). A AG aparece depois dos 50 anos, com progressão lenta de pequenos focos, geralmente após a regressão de drusas, com diâmetro horizontal maior, está relacionada com fatores de risco genético e ambiental.4 Ferrara etal. recentemente descreveram a apresentação fenotípica associada à mutação genética de fator do complemento H R1210C, uma variante rara, fortemente associada com a acumulação de drusas moles na mácula, bem como com rápida DMA avançada com AG.5 No entanto, pacientes EMAP, com menos de 50 anos de idade, exibem uma progressão mais rápida de atrofia com um diâmetro vertical maior e sem formação de drusas.1,2
A EMAP têm características que diferem das outras distrofias retinianas similares.10 Elas são: ausência de depósitos de pigmento na mácula, no equador, ou na periferia; vasos retinianos normais; diminuição moderada de respostas no ERG; sem perda visual periférica; sem evidência de hereditariedade familiar e lesões retinianas características que diferenciam EMAP de distrofias de cone e de distrofias cone-rod.7 Estas características também diferenciam EMAP de distrofias maculares autossômicas dominantes, como distrofia de fundo de Sorsby,8 distrofia macular da Carolina do Norte,9 e distrofia coroidea areolar central,10 e da degeneração macular retiniana tardia.11 Uma limitação importante na descrição da EMAP como uma entidade clínica é a falta de mapeamento genético.6 Uma melhor caracterização dos perfis genéticos em pacientes EMAP irá proporcionar uma melhor compreensão da sua patogênese e de tratamentos futuros possíveis para tratar esta condição que tanto ameaça a visão.
REFERÊNCIAS
1 Hamel CP, Meunier I, Arndt C, et al. Extensive macular atrophy with pseudodrusen-like appearance: a new clinical entity. Am J Ophthalmol. 2009;147(4):609-20.
2 Querques G, Blanco R, Puche N, Massamba N, Souied EH. Extensive macular atrophy with pseudodrusen-like appearance. Ophthalmology 2013;120:429 e1-e2.
3 Kamami-Levy C., Querque G., Rostaqul O., Blanco-Garavito R., Souied E.H. Choroidal neovascularization associated with extensive macular atrophy with pseudodrusen-like appearance. Journal français d'ophtalmologie 2014;37:780-86.
4 Sobrin L, Seddon JM. Nature and nurture: genes and environment predict onset and progression of macular degeneration. Prog Retin Eye Res. 2014;40: 1 -15.
5 Ferrara D, Seddon JM. Phenotypic Characterization of Complement Factor H R1210C Rare Genetic Variant in Age-Related Macular Degeneration. JAMA Ophthalmol 2015;133(7):785-91.
6 Boon CJ, Theelen T, Hoyng CB. Extensive macular atrophy with pseudodrusen-like appearance: a new clinical entity. Am J Ophthalmol. 2009 Jul;148(1 ):173-4; author reply 174-5.
7 Michaelides M, Hardcastle AJ, Hunt DM, Moore AT. Progressive cone and cone-rod dystrophies: phenotypes and underlying molecular genetic basis. Surv Ophthalmol 2006; 51:232-258.
8 Gliem M, Müller PL, Mangold E, Holz FG, et al. Sorsby Fundus Dystrophy: Novel Mutations, Novel. Phenotypic Characteristics, and Treatment Outcomes. Invest Ophthalmol Vis Sci. 2015;56(4):2664-76.
9 Khurana RN, Sun X, Pearson E, Yang Z, et al. A reappraisal of the clinical spectrum of North Carolina macular dystrophy. Ophthalmology. 2009;116(10):1976-83.
10 Smailhodzic D, Fleckenstein M, Theelen T, Boon CJ, et al. Central areolar choroidal dystrophy (CACD) and age-related macular degeneration (AMD): differentiating characteristics in multimodal imaging. Invest Ophthalmol Vis Sci. 2011;52(12):8908-18.
11 Borooah S, Collins C, Wright A, Dhillon B. Late-onset retinal macular degeneration: clinical insights into an inherited retinal degeneration. Br J Ophthalmol 2009;93:284-289.

Fonte de financiamento: declaram não haver.
Conflito de interesses: declaram não haver.
Recebido em:
3 de Agosto de 2015.
Aceito em:
3 de Setembro de 2015.