Leonardo José Barbosa1; Ahlys Ayumi Nagai Miyazaki1,2; Marianna Almeida Hollaender1; Júlia Furtado Heringer1; Stefanie Hitomi de Nishi Lee1; Ana Vega Carreiro de Freitas1; Amaryllis Avakian Shinzato1; Pedro Carlos Carricondo1
DOI: 10.17545/eOftalmo/2021.0017
RESUMO
A catarata, opacificação do cristalino, é a principal causa de cegueira no mundo segundo a Organização Mundial de Saúde (OMS). Em pleno século XXI, a catarata representa 51% das causas de cegueira da população mundial. Apesar de a compreensão da fisiologia da visão ter iniciado há mais de 3000 anos e os primeiros relatos escritos de cirurgia de catarata datarem do século I, ainda não se encontrou uma solução mundial para o acesso universal à cirurgia de remoção do cristalino opacificado. A reversibilidade da catarata com a cirurgia de remoção do cristalino (facectomia), torna necessário que a comunidade médica busque métodos para difundir o acesso a esse tratamento e o entendimento da história da cirurgia de catarata pode ajudar nessa busca. Novas técnicas cirúrgicas continuam surgindo e a capacitação para o aumento no número de médicos oftalmologistas capazes de diagnosticar e realizar a cirurgia de extração do cristalino opacificado pode beneficiar pacientes sem acesso ao tratamento. A história evidencia que, mesmo após mais de dois milênios do início da realização do procedimento de catarata, equipamentos, materiais e técnica cirúrgica permanecem em constante evolução. A história da catarata é descrita nesse artigo.
Palavras-chave: Catarata; Cirurgia; História.
ABSTRACT
Cataract, the opacification of the crystalline lens, is the leading cause of blindness in the world according to the World Health Organization. In the 21st century, cataracts represent 51% of the causes of blindness in the population worldwide. Although the study of the physiology of vision was initiated more than 3000 years ago and the first written reports of cataract surgery date back to the 1st century, a solution has not yet been found for universal access to opacified lens removal surgery. Cataract reversibility with lens removal surgery (phacectomy) makes it necessary for the medical community to seek methods to improve access to this treatment, and understanding the history of cataract surgery can help in this quest. New surgical techniques continue to emerge, and training programs aimed at increasing the number of ophthalmologists who are able to diagnose and perform opacified lens extraction surgery can benefit patients without access to treatment. History shows that even more than two millennia after the start of cataract surgeries, equipment, materials, and surgical techniques are still constantly evolving. The history of cataract is described in this article.
Keywords: Cataract; Surgery; History.
INTRODUÇÃO
Em pleno século XXI, a catarata ainda é a causa de 51% das cegueiras diagnosticadas na população mundial1. Apesar de a fisiologia da visão ser estudada há mais de 3000 anos e os primeiros relatos escritos de cirurgia de catarata datarem do século I2,3, ainda não se encontrou uma solução mundial para o acesso universal à cirurgia de remoção do cristalino opacificado. Ao contrário de doenças irreversíveis como glaucoma e degeneração macular relacionada à idade, a reversibilidade da catarata com a cirurgia de remoção do cristalino (facectomia), torna necessário que a comunidade médica busque métodos para difundir o acesso a esse tratamento e o entendimento da história da cirurgia de catarata pode ajudar nessa busca. Novas técnicas cirúrgicas continuam surgindo e o treinamento visando o aumento no número de médicos oftalmologistas capazes de diagnosticar e realizar a cirurgia de extração do cristalino opacificado pode beneficiar pacientes sem acesso ao tratamento.
O conhecimento da anatomia e fisiologia do olho teve início há mais de 3000 anos2,3. Infelizmente, muitos dos relatos antigos se perderam. Dentre os mais antigos, estão as descrições feitas por Hipócrates (400 a.C.) e por Aristóteles (350 a.C.), que descrevem o olho humano de forma detalhada mas com alguns equívocos como, por exemplo, acreditar que o cristalino correspondia ao acúmulo de substâncias no pós-morte.
Denomina-se catarata qualquer opacificação do cristalino que possa causar a degradação de sua qualidade óptica, causando sintomas e perda visual. Embora as primeiras descrições anatômicas do cristalino e da zônula remetam ao século I, relatadas por Celsus, Rufus e Galeno, a função óptica do cristalino foi estabelecida apenas no século XVI, por Francisco Manrolycus. Até esta época, acreditava-se que a catarata era semelhante ao glaucoma, pois ambas levavam cegueira e ao “embranquecimento do olho”. Somente em 1650, Rolfinck descreveu a catarata como sendo a opacificação do cristalino. Essa ideia foi rejeitada inicialmente pela grande maioria dos médicos, sendo aceita somente um século depois4.
O primeiro registro de cirurgia de catarata data do século V AC, que descreve a luxação do cristalino para a cavidade vítrea através da aplicação de uma força contusa diretamente no globo ocular, por meio de um instrumento rombo, gerando a desinserção ou ruptura das fibras zonulares e deslocamento posterior do cristalino e de sua cápsula, por destruição das estruturas de suporte9 (Figura 2). Infelizmente essa técnica ainda é utilizada em países em desenvolvimento, como na Nigéria e no Oeste da África10.

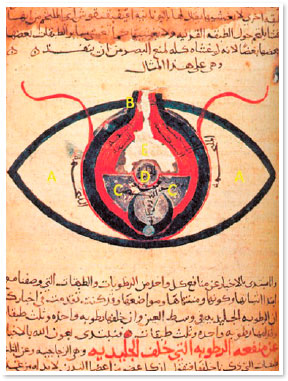
Séculos depois, Avicenna modificou a técnica e passou a utilizar um instrumento afiado e pontiagudo, o qual deveria ser inserido no olho de modo a romper as fibras zonulares e causar o deslocamento cristaliniano5. De acordo com Avicenna, a cirurgia não deveria ser realizada em locais com muita luminosidade. Durante o procedimento, o paciente deveria olhar para o nariz, enquanto o cirurgião inseria um instrumento pontiagudo (meghdaha) pelo limbo até atingir a câmara anterior e conseguir mobilizar o cristalino (Figura 1, 3). A catarata era então empurrada até o ângulo inferior da câmara anterior, até liberação do eixo pupilar. Portanto, o cristalino opacificado não era removido do olho do paciente5.

A primeira remoção cirúrgica do cristalino foi realizada em Paris, em 1748. Em 1752, Jacques Daviel apresentou seu trabalho intitulado, “Um novo método para a cura da catarata por meio da extração do cristalino”6. A técnica envolvia a remoção do cristalino opaco inteiro através de uma ampla incisão corneana e a abertura da cápsula anterior. Era imprescindível que a lente permanecesse intacta enquanto a extração estava sendo realizada. Desse modo, o procedimento era reservado para cristalinos “maduros”: tão endurecidos que não se quebrariam durante o procedimento de extração. Isso limitava a cirurgia a apenas cataratas muito avançadas. Como não havia sutura disponível nessa época, os pacientes permaneciam imobilizados com sacos de areia ao redor da cabeça, até a cicatrização, o que gerava risco de morte por embolia pulmonar. Esta técnica foi denominada extração extracapsular do cristalino, tendo sido utilizada por algum tempo e depois abandonada, para somente dois séculos depois ser resgatada.
Paralelamente, outras técnicas surgiram, como a da extração intracapsular, descrita inicialmente por St. Yves em 1722, e aperfeiçoada por Samuel Sharp e posteriormente por George Beer, em 17994.
Essa técnica ganhou ainda mais força a partir do século XIX, após o advento das técnicas de anestesia geral e da apresentação do efeito anestésico tópico da cocaína por Karl Kö ller . A anestesia local em oftalmologia foi apresentada no Congresso de Heidelberg, em 15 de setembro de 1884, tendo sido aceito imediatamente no mundo inteiro7,8.
Exceto pela realização da extração do cristalino doente através de uma incisão corneana ampla, e das inovações em anestesia, não houve muita mudança na técnica cirúrgica até o final do século XIX. Através dos estudos de Macnamara, Molrony e Smith, na Índia, a extração intracapsular começou a ganhar popularidade12. Como não havia microscópio cirúrgico, a remoção de córtex era dificultada na extração extracapsular, o que resultava em intensa inflamação e rápida opacificação da cápsula posterior. Já a técnica intracapsular, por remover todo o cristalino com o saco capsular, não resultava nessas complicações. Após a Segunda Guerra Mundial, devido ao aperfeiçoamento da extração intracapsular com iridectomia, alguns médicos, acreditavam que não se poderia mais melhorar tal técnica cirúrgica13.
Porém, após a introdução do microscópio cirúrgico em 1950 por Harms e Barraquer, mais inovações começaram a surgir como o uso de uma enzima para desfazer a zônula (Joaquim Barraquer, 1958) ou a crioextração (T . Krwawicz, 1961), ambas técnicas facilitavam a remoção intracapsular do cristalino, melhorando os resultados cirúrgicos14. Mesmo após a cirurgia, os pacientes permaneciam afácicos, necessitando de pesados óculos com lentes positivas popularmente conhecidas como “fundo de garrafa”, para a correção refracional.
Em 1949, o inglês Harold Ridley desenvolvia a primeira lente intraocular artificial. Ridley já havia observado, como cirurgião militar na Segunda Guerra Mundial, que materiais como vidro e acrílico, em certas condições, pareciam inertes com relação aos tecidos. Fragmentos estilhaçados que penetravam o olho da tripulação de aviões pareciam gerar reação tecidual insignificante, exceto se partes pontiagudas ficassem em contato com uma porção móvel do olho15. Em 29 de novembro de 1949, Ridley implantou a primeira lente intra-ocular, marcando uma mudança importante na oftalmologia (Figura 4). De modo interessante, o material usado por ele naquela época, o polimetilmetacrilato (PMMA) ainda é a matéria prima de muitas lentes intraoculares implantadas atualmente15. Porém, as primeiras lentes implantadas eram grandes, pesadas e posicionadas no segmento anterior do olho, gerando um número grande de complicações. Após cerca de 10 anos, Cornelius Birkhorst desenvolveu, a partir do modelo de Ridley, uma lente mais bem adaptada ao olho humano. Birkhorst além de aprimorar a lente intraocular de Ridley, também determinou que a melhor técnica cirúrgica para seu implante seria a extracapsular, por preservar a cápsula posterior, permitindo o posicionamento ideal da lente no segmento posterior do olho16.

A maior inovação do século passado deu-se com a introdução da facoemulsificação, pelo Dr. Charles Kelman, em 196717 (Figura 5). Em 1965, ele sugeriu que o aparelho de ultrassom utilizado por dentistas poderia ser adaptado para a fragmentação do cristalino em pedaços pequenos que poderiam ser aspirados em seguida. Depois de dois anos de trabalho árduo, Kelman apresentou seu engenhoso equipamento de facoemulsificação18. Por este método, através de uma abertura na cápsula anterior, o cristalino seria fragmentado por ultrassom e aspirado pela cânula do próprio equipamento. Desta forma, o cirurgião trabalharia em um sistema fechado, evitando a realização de amplas incisões e, consequentemente, exposição excessiva do interior do globo19. A primeira facoemulsificação em olho humano demorou 76 minutos, e o equipamento era grande, pouco eficiente, de difícil controle e extremamente pesado18. Inicialmente, esta técnica foi alvo de muitas críticas, pois envolvia custo para aquisição e manutenção do equipamento, treinamento da equipe, curva de aprendizado do cirurgião, e não parecia oferecer superioridade em termos de resultados cirúrgicos quando comparada às técnicas mais comumente utilizadas na época20.

A cirurgia extra-capsular continuava o procedimento padrão até o desenvolvimento o viscoelástico Healon (Pharmacia Corp.; atualmente produzido pela Advanced Medical Optics, Inc., Santa Ana, CA), por Robert Stegmann, e David Miller, em meados dos anos 1980. Tal inovação aumentou drasticamente a popularidade da facoemulsificação, pela diminuição significante do dano endotelial, estimulando o surgimento de novas substâncias semelhantes20. Com o aumento no número de adeptos da nova cirurgia com incisão pequena, estimulou-se, também, o desenvolvimento de lentes intraoculares dobráveis, que pudessem ser implantadas através de incisões cada vez menores21. Atualmente, há lentes que podem ser implantadas por incisões tão pequenas quanto 1.8 mm22. Na busca do melhor resultado cirúrgico e do implante mais próximo da anatomia do cristalino saudável, foi criada a técnica de capsulorrexe circular e contínua por Gimbel, 199023. Dessa maneira, a possibilidade do implante de LIO no saco capsular tornou-se mais seguro e previsível24, permitindo que as atenções se voltassem para o aspecto refrativo da cirurgia de catarata, ou seja, que o paciente ficasse com a menor refração residual após o procedimento de facoemulsificação com implante de lente com o poder refrativo o mais próximo possível ao necessário para a focalização das imagens na retina.
A previsibilidade do procedimento tornou possível o surgimento de lentes intraoculares que pudessem compensar não apenas o poder refracional esférico (LIOs esféricas) perdido pela remoção do cristalino, mas também outras aberrações ópticas como a asfericidade (LIOs asféricas)25 e toricidade corneanas (LIOs tóricas)26. A remoção cirúrgica do cristalino suprime drasticamente a acomodação cristaliniana e pacientes submetidos ao implante desses tipos de lente permaneciam dependentes de óculos para a visão de perto e leitura. Na expectativa da independência da correção óptica, a indústria oferece continuamente novos modelos de lentes intraoculares que realizem a correção refracional tanto para a visão à distância quanto para perto. Há disponíveis lentes bifocais (correção para longe e perto), trifocais (longe, perto e média distância) e, mais recentemente, lentes de foco estendido, que proporcionam visão continuamente nítida entre as distâncias (longe-intermediária ou intermediária-perto)27.
O surgimento recente de novas tecnologias como o LASER de femtosegundo para a realização de alguns passos da cirurgia de catarata (FLACS - Femtosecond LASER Assisted Cataract Surgery), como incisões, capsulotomia e fratura do núcleo demonstra a intenção cada vez maior em facilitar o aprendizado e continuar tornando a cirurgia de catarata mais segura e previsível28.
Muito embora a tecnologia tenha avançado rapidamente nos últimos 30 anos, mais da metade dos pacientes diagnosticados com cegueira no mundo tem a catarata como doença ocular principal1. A formação de novos médicos oftalmologistas, capazes de diagnosticar uma doença ocular tão prevalente e realizar a cirurgia de remoção de catarata, quer seja extracapsular ou por facoemulsificação, coloca à disposição da população profissionais com o preparo necessário para atender às necessidades de pacientes de todos os níveis sócio-econômico-culturais.
O treinamento de médicos residentes continua o principal pilar da especialização no Brasil. E, a maioria dos hospitais com programas adequados pertence ao Sistema Único de Saúde (SUS) brasileiro. Alguns estudos mostram que o financiamento público dos procedimentos de facoemulsificação pelos SUS são muitas vezes insuficientes para adequar os custos do cirurgião em treinamento, pelo maior número de complicações e maior gasto de material por cirurgia29. Um estudo de 201029 mostrou que existe diferença significativa entre os gastos por cirurgia realizada por cirurgião experiente versus cirurgias de catarata realizadas por residentes em treinamento, mesmo quando estes estão no terceiro e último ano de formação do Programa de Oftalmologia Brasileiro.
É reconhecido que cirurgiões em fase de aprendizado apresentam mais complicações em cirurgias de catarata, mesmo quando orientados por staffs experientes, quando comparados à cirurgiões que já dominam a técnica de facoemulsificação30. Apesar de não haver uma padronização sobre como a cirurgia de catarata deva ser ensinada, alguns métodos são propostos com a finalidade de mitigar complicações operatórias oriundas da curva de aprendizado de facoemulsificação. Um exemplo é o aprendizado desta técnica “de trás para frente”, ou seja, a divisão da cirurgia em passos específicos dos quais o cirurgião em treinamento realiza apenas o último inicialmente e o restante é realizado por um cirurgião mais experiente31. À medida que o aluno se encontra familiarizado com aquele passo, passa a realizar o anterior, e assim sucessivamente até que esteja preparado para a realização do procedimento completo. Tal metodologia tem por princípio que os passos iniciais da facoemulsificação como a capsulorrexe e a fratura do núcleo são os mais críticos para a boa evolução do procedimento e não devem ser realizados por cirurgião ainda não confortável com o ambiente intraocular. Outras escolas defendem o aprendizado inicial da cirurgia extracapsular, a qual promove a prévia familiarização com o ambiente cirúrgico ocular e com os equipamentos cirúrgicos oftalmológicos32 e pode ser usada como técnica cirúrgica alternativa de resgate em casos de facoemulsificações complicadas. Após habilitado na realização da cirurgia extracapsular e familiarizado com o aparato micro-cirúrgico, o residente pode então migrar para a cirurgia de facoemulsificação.
Além do ensino direto em centro cirúrgico, outras formas de educação em cirurgia de catarata são amplamente utilizadas para otimizar a curva de aprendizado cirúrgica. Wetlab, drylabs, simuladores virtuais fazem parte do novo arsenal de ensino em oftalmologia. E, a presença de um currículo estruturado baseado em competências com feedback formativo aos residentes ao invés do currículo tradicional apenas com aulas e testes teóricos, pode reduzir complicações. Tal descoberta foi demonstrada por Rogers no serviço Veterans Affairs Medical Center em Iowa, o qual apresentou redução estatisticamente significante de complicações em cirurgia de catarata de 7.17% antes de mudanças curriculares para 3.77% com o currículo otimizado33.
No Brasil, a Resolução CNRM No 02 /2006 determina a realização de pelo menos 50 cirurgias por residente em cada ano do programa de residência em oftalmologia. No entanto, não especifica qual o tipo de procedimento que deve ser realizado na formação oftalmológica34. Nos Estados Unidos, por exemplo, o Conselho de Acreditação para Graduação em Educação Médica exige a realização de pelo menos 86 cirurgias de catarata durante os três anos de especialização35. Alguns estudos mostram que o número de complicações de cirurgias de catarata realizadas por residentes diminui 50% após 40 casos e torna-se aceitável após aproximadamente 100 casos36. A história nos mostra que, mesmo após mais de dois milênios do início da realização do procedimento de catarata, equipamentos, materiais e técnica cirúrgica permanecem em constante evolução. O desafio de ensinar a técnica da cirurgia de catarata inclui, além dessa constante mudança, a necessidade de acesso a centros de treinamento em todas as regiões. Embora o cirurgião em treinamento demande mais recursos financeiros e necessite de supervisão qualificada, um oftalmologista adequadamente preparado para a realização da cirurgia de catarata poderá beneficiar, ao longo de sua carreira, uma grande parcela da população, que ainda perde a função essencial da visão, por uma doença totalmente reversível cirurgicamente.
REFERÊNCIAS
1. Pascolini D, Mariotti SP. Global estimates of visual impairment: 2010. Br J Ophthalmol. 2012;96(5):614-8.
2. Avicenna, Al-Qanun fi’l-tibb. In: Hesan Ja`far, editor. Al-Hilal. Beirut: Dar-ol- Behar, 2009.
3. Avicenna, The Canon (Persian translation), 3rd edition. Tehran: Ministry of Health and Medical Education of Iran, Committee of Computerizing Medicine and Hygiene, 2007.
4. Emery JM, McIntyre DJ. History of extracapsular cataract surgery. In: Emery JM, McIntyre DJ, eds. Extracapsular cataract surgery. St.Louis: C.V. Mosby, 1983.
5. Nejabat M, Maleki B, Nimrouzi M, Mahbodi A, Salehi A. Avicenna and cataracts: a new analysis of contributions to diagnosis and treatment from the canon. Iranian Red Crescent Med J. 2012;14(5):265-70.
6. Hubbell AA. Jacques Daviel and the beginnings of the modern operation of extraction of cataract. JAMA 1902;39:177-85.
7. Wyklicky H, Skopec M. Carl Koller and his time in Vienna. Regional anaesthesia. In: Scott DB, McClure J, Wildsmith JAW, eds. Regional Anaesthesia 1884Y1984. Sweden: ICM AB; 1984:12Y17.
8. Honegger H, Hessler H. Die Entdeckung der Lokalana ̈sthesie. Klin Monbl Augenheilkd Augena ̈rztl Fortbild. 1970;157:428Y438; 569Y578, 714Y723.
9. Davis G. The Evolution of Cataract Surgery. Mo Med 2016;113(1): 58-62.
10. Isawumi MA, Kolawole OU, Hassan MB. Couching techniques for cataract treatment in Osogbo, Southwest Nigeria. Ghana Med J. 2013;47(2):64-9.
11. Grzybowski A, Ascaso F. Sushruta in 600 B.C. Introduced Extraocular Expulsion of Lens Material. Acta Ophthalmol. 2014; 92(2):194-7.
12. Smith H. The treatment of cataract and some other common ocular affections. 2nd edition. Calcutta: Butterworth & Co, 1928.
13. Kirby D. History of cataract surgery. In: Surgery of cataract. Philadelphia: J.B. Lippincott, 1950.
14. Blodi FC. Cataract surgery. In: Albert DM, Edwards DD, eds. The history of ophthalmology. Oxford: Blackwell Science, 1996.
15. Apple DJ, Sims J. Harold Ridley and the invention of the intraocular lens. Surv Ophthalmol. 1996;40(4):279-92.
16. Nordlohne ME. The intraocular implant lens development and results with special reference to the Birkhorst lens. 2nd ed. Baltimore: Williams and Wilkins Company, 1975.
17. Kelman CD. Phacoemulsification and aspiration. A new technique of cataract removal. A preliminary report. Am J Ophthalmol. 1967;64(1):23-35.
18. Kelman CD. The History and Development of Phacoemulsification. Int Ophthalmol Clin. 1994;34(2):1-12.
19. Kelman CD. Phacoemulsification and aspiration. A progress report. Am J Ophthalmol. 1969;67(4):464-77.
20. Linebarger EJ, Hardten DR, Shah GK, Lindstrom RL. Phacoemulsification and Modern Cataract Surgery. Surv Ophthalmol. 1999;44(2):123-47.
21. Martin AI, Sutton G, Hodge C. The Evolution of Cataract Surgery: Controversies through the ages. Asia Pac J Ophthalmol (Phila). 2013;2(4):213-6.
22. Song E, Li X, Bi MC, Ren H, Wang D, Cui ZH, et al. A comparison of surgical efficacy between a 1.8-mm microincision and 3.2-mm and 5.5-mm incisions for phacoemulsification. Int J Ophthalmol. 2018;11(3):516-9.
23. Gimbel HV, Neuhann T. Development, advantages, and methods of the continuous circular capsulorhexis technique. J Cataract Refract Surg. 1990;16(1):31-7.
24. Jaffe NS. History of Cataract Surgery. Ophthalmology. 1996;103: S5-S16.
25. Kershner RM. Retinal image contrast and functional visual performance with aspheric, silicone, and acrylic intraocular lenses. Prospective evaluation. J Cataract Refract Surg. 2003; 29(9):1684-94.
26. Novis C. Astigmatism and toric intraocular lenses. Curr Opin Ophthalmol. 2000;11(1):47-50.
27. Bohm M, Petermann K, Hemkeppler E, Kohnen T. Defocus curves of 4 presbyopia-correcting IOL designs: Diffractive panfocal, diffractive trifocal, segmental refractive, and extended-depth-of-focus. J Cataract Refract Surg. 2019;45(11):1625- 36.
28. Kanclerzk P, Alio JL. The benefits and drawbacks of femtosecond laser- assisted cataract surgery. Eur J Ophthalmol. 2020; 1120672120922448.
29. Carricondo PC. Análise dos custos e complicações da cirurgia de catarata realizada por residentes. 2010. Tese de Doutorado. Universidade de São Paulo.
30. Taravella MJ, Davidson R, Erlanger M, Guiton G, Gregory D. Characterizing the learning curve in phacoemulsification. J Cataract Refract Surg. 2011;37(6):1069-75.
31. Suryawanshi M, Gogate P, Kulkarni AN, Biradar A, Bhomaj P. Comparison of the Posterior Capsule Rupture Rates Associated with Conventional (Start to Finish) Versus Reverse Methods of Teaching Phacoemulsification. Middle East Afr J Ophthalmol. 2016;23(2):163-7.
32. Soriano ES. Cataract surgery teaching. Arq Bras Oftalmol. 2015; 78(4):V-VI.
33. Rogers GM, Oetting TA, Lee AG, Grignon C, Greenlee E, Johnson AT, et al. Impact of a structured surgical curriculum on ophthalmic resident cataract surgery complication rates. J Cataract Refract Surg. 2009;35(11):1956-60.
34. Resolução CNRM No 02 /2006, disponível em: http://portal.mec.gov.br/dmdocuments/resolucao02_2006.pdf.
35. Rowden A, Krishna R. Resident cataract surgical training in United States residency programs. J Cataract Refract Surg. 2002; 28(12):2202-5.
36. Ament CS, Henderson BA. Optimizing resident education in cataract surgery. Curr Opin Ophthalmol. 2011;22(1):64-7.
INFORMAÇÃO DOS AUTORES
Financiamento: Declaram não haver
Conflitos de Interesse: Declaram não haver
Recebido em:
13 de Novembro de 2020.
Aceito em:
21 de Dezembro de 2020.